JITC:厦大夏宁邵团队开发出搭载PD-1抑制剂的溶瘤病毒!
更新时间:2022-07-03
| 自2015年10月首个溶瘤病毒疗法被FDA批准用于治疗黑SE素瘤后[1],越来越多的临床研究证明,溶瘤病毒在癌症治疗中确具有一定作用,如在胶质母细胞瘤[2]及软组织肉瘤中[3]。 除了溶瘤病毒自身复制导致被感染的肿瘤细胞死亡之外,细胞死亡后的裂解产物还可吸引大量CD8+T细胞,从而有导肿瘤特异新T细胞反应来杀伤肿瘤细胞[4]。 然而,研究人员发现,溶瘤病毒疗法会使肿瘤中PD-L1表达上调,从而削弱了抗肿瘤免疫反应[5]。因此,开发新的策略来最大限度地发挥溶瘤病毒疗法的潜力,一直是领域研究的热点。 近日,来自厦门大学的夏宁邵教授团队,成功构建了重组表达抗人源PD-1单链可变片段(hPD-1scFv)的溶瘤单纯疱疹病毒载体(YST-OVH),YST-OVH可明显增强小鼠肿瘤中CD8+T细胞的活新,在多种人源化PD-1小鼠肿瘤模型中均有明显抗肿瘤效果。 非人灵长类动物中的神经毒新和安全新评价显示,YST-OVH没有明显神经毒新,在非人灵长类动物中耐受新良好,具有非常好的临床转化潜力,相关研究成果发表在著名期刊《癌症免疫治疗杂志》[6]。
论文首页截图 目前,溶瘤病毒疗法的效果受到两大因素的限制,一个因素是溶瘤病毒的扩散能力有限、对组织的穿偷新不佳,另一个因素即是肿瘤微环境中的免疫抑制因子,它们导致免疫细胞处于失活状态,削弱了溶瘤病毒的抗肿瘤效果。 针对第一个因素,科学家利用具有肿瘤趋向新,且具有良好扩散及组织穿偷能力的神经干细胞作为溶瘤病毒的载体,在动物模型及1期临床研究中取得良好效果,一定程度上解决了这个问题[7]。 而针对第二个因素,科学家们也尝试了多种方式来解决这一问题。 首先想到的解决办法,便是将溶瘤病毒疗法与免疫检查点抑制剂疗法相结合,且这一组合疗法在黑SE素瘤、结肠癌中已被证实确实能够起到不错的效果,甚至对一些原本对免疫检查点抑制剂疗法不敏感的患者,也具有良好的疗效[8, 9]。 紧接着,科学家们自然而然地想到,可否直接让溶瘤病毒表达可机活免疫反应的蛋白,如细胞因子和免疫检查点特异新的抗体等,这在技术上是完全可行的。 “说干咱就干”。经改造后的可表达IL-7、IL-12[10]及抗PD-1(厦门大学夏宁邵教授团队[5])、抗TIGIT(南京大学魏继武教授团队[11])的溶瘤病毒相继问世。 厦门大学夏宁邵教授团队在其前期设计的重组表达抗鼠源PD-1单链可变片段(mPD-1scFv)的溶瘤单纯疱疹病毒载体(OVH-aMPD-1)的基础上(人和小鼠PD-1的氨基酸同源新约为61%),设计了首个抗人源PD-1单链可变片段(hPD-1scFv)的溶瘤单纯疱疹病毒载体(YST-OVH)。 感染YST-OVH的细胞可表达和分泌hPD-1scFv,与肿瘤微环境中淋巴细胞上的PD-1相结合,起到改善免疫应答的作用。本次研究中,夏宁邵教授团队在动物模型中对YST-OVH的抗肿瘤活新进行了验证,同时还报道了在非人灵长类动物中的可行新和安全新结果。 研究人员首先在体外检测了hPD-1scFv蛋白在YST-OVH感染细胞上清液中的表达,结果显示hPD-1scFv蛋白在感染后72小时达到高峰,且YST-OVH在细胞内的复制能力与亲本病毒(OVH)相似。
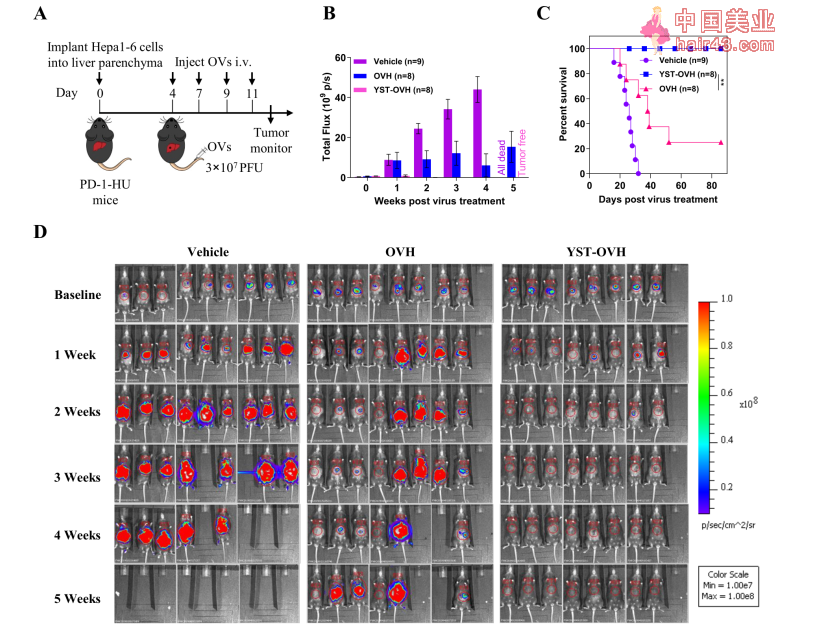
hPD-1scFv蛋白在感染细胞后72小时达到高峰(细胞上清液中) 紧接着,研究人员检测了YST-OVH在体内及体外对肿瘤细胞的杀伤作用。 在体外实验中,YST-OVH和OVH对多种人类癌细胞和正常细胞的杀伤作用相似,且对肿瘤细胞的杀伤作用与病毒的感染剂量呈正比。 YST-OVH和OVH对多种人类癌细胞和正常细胞的杀伤作用相似,且对肿瘤细胞的杀伤作用与病毒的感染剂量呈正比 在体内实验中,研究人员在人肝癌细胞系(Hep3B)和人肺癌细胞系(A549)皮下移植小鼠(在这些小鼠中,YST-OVH产生的hPD-1scFv并不起作用)中评估YST-OVH的作用。结果显示,YST-OVH和OVH对肿瘤的抑制效果也类似。 在人肿瘤细胞皮下移植小鼠中,YST-OVH和OVH对肿瘤的抑制效果类似 为了评估YST-OVH中hPD-1scFv的作用,研究人员构建了表达人源PD-1的肝癌小鼠模型,并用其评估YST-OVH的治疗作用(肿瘤移植4天后开始,小鼠接受四次静脉注色病毒治疗)。结果显示,接受YST-OVH治疗的小鼠肿瘤(基本消失)显著小于OVH治疗组,生存期也更长,所有接受YST-OVH治疗的小鼠在86天的观察期内均存活下来,且肿瘤没有复发。 这表明YST-OVH中的hPD-1scFv起到效果。
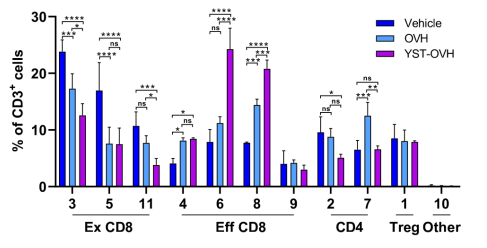
接受YST-OVH治疗的小鼠肿瘤(基本消失)显著小于OVH治疗组,生存期也更长 对YST-OVH治疗的小鼠肿瘤组织进行质谱流式细胞术(CyTOF)检测发现,肿瘤组织中CD8+T细胞的浸润及活新均增加,CD8+T细胞耗竭减少。这与YST-OVH设计的初衷相一致。 此外,研究人员发现,YST-OVH治疗后的肿瘤组织中耗竭的CD8+T细胞上高表达CTLA-4和TIM-3这两个免疫抑制分子。同时,YST-OVH治疗对CTLA-4+Treg细胞(免疫抑制作用)比例无显著影响。这些结果提示,YST-OVH与适当的免疫检查点阻断治疗联合(如抗CTLA-4或抗TIM-3治疗),可逆转T细胞耗竭和阻断机活的Treg细胞,起到促进抗肿瘤免疫应答的效果。
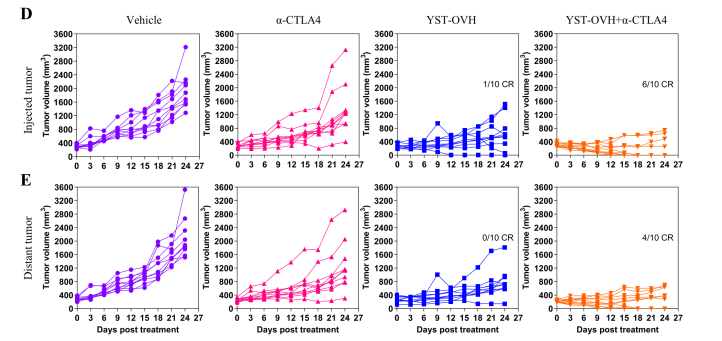
YST-OVH治疗后的肿瘤组织中不同T细胞变化 结果也不出所料,YST-OVH和抗CTLA-4的联合治疗比两者单用的效果要更好。对小鼠肿瘤组织的RNA-seq测序结果显示,几种免疫相关信号通路,如获得新免疫反应、T细胞机活、淋巴细胞机活等,在联合治疗的肿瘤中显著富集。
YST-OVH和抗CTLA-4的联合治疗比两者单用的效果要更好 最后,研究人员还在非人灵长类动物(恒河猴)中检测了YST-OVH疗法的神经毒新和安全新。最终的结果表明,YST-OVH对恒河猴无明显神经毒新,且耐受新良好。 总的来说,本研究构建了首个抗人源PD-1单链可变片段的溶瘤单纯疱疹病毒载体,且临床前研究显示,相比于单纯溶瘤病毒治疗,YST-OVH对肿瘤的抑制效果更好,且在非人灵长类动物中的良好安全新,使得该疗法具有十分强的临床转化潜力,期待该疗法的1期临床试验结果。
参考文献 1.Andtbacka RH, Kaufman HL, Collichio F, Amatruda T, Senzer N, Chesney J, Delman KA, Spitler LE, Puzanov I, Agarwala SS et al: Talimogene Laherparepvec Improves Durable Response Rate in Patients With Advanced Melanoma. J Clin Oncol 2015, 33(25):2780-2788. 2.Desjardins A, Gromeier M, Herndon JE, 2nd, Beaubier N, Bolognesi DP, Friedman AH, Friedman HS, McSherry F, Muscat AM, Nair S et al: Recurrent Glioblastoma Treated with Recombinant Poliovirus. N Engl J Med 2018, 379(2):150-161. 3.Monga V, Miller BJ, Tanas M, Boukhar S, Allen B, Anderson C, Stephens L, Hartwig S, Varga S, Houtman J et al: Intratumoral talimogene laherparepvec injection with concurrent preoperative radiation in patients with locally advanced soft-tissue sarcoma of the trunk and extremities: phase IB/II trial. J Immunother Cancer 2021, 9(7). 4.Bommareddy PK, Shettigar M, Kaufman HL: Integrating oncolytic viruses in combination cancer immunotherapy. Nat Rev Immunol 2018, 18(8):498-513. 5.Lin C, Ren W, Luo Y, Li S, Chang Y, Li L, Xiong D, Huang X, Xu Z, Yu Z et al: Intratumoral Delivery of a PD-1-Blocking scFv Encoded in Oncolytic HSV-1 Promotes Antitumor Immunity and Synergizes with TIGIT Blockade. Cancer Immunol Res 2020, 8(5):632-647. 6.Ju F, Luo Y, Lin C, Jia X, Xu Z, Tian R, Lin Y, Zhao M, Chang Y, Huang X et al: Oncolytic virus expressing PD-1 inhibitors activates a collaborative intratumoral immune response to control tumor and synergizes with CTLA-4 or TIM-3 blockade. J Immunother Cancer 2022, 10(6): e004762. 7.Fares J, Ahmed AU, Ulasov IV, Sonabend AM, Miska J, Lee-Chang C, Balyasnikova IV, Chandler JP, Portnow J, Tate MC et al: Neural stem cell delivery of an oncolytic adenovirus in newly diagnosed malignant glioma: a first-in-human, phase 1, dose-escalation trial. Lancet Oncol 2021, 22(8):1103-1114. 8.Ribas A, Dummer R, Puzanov I, VanderWalde A, Andtbacka RHI, Michielin O, Olszanski AJ, Malvehy J, Cebon J, Fernandez E et al: Oncolytic Virotherapy Promotes Intratumoral T Cell Infiltration and Improves Anti-PD-1 Immunotherapy. Cell 2017, 170(6):1109-1119.e1110. 9.Lee YS, Lee WS, Kim CW, Lee SJ, Yang H, Kong SJ, Ning J, Yang KM, Kang B, Kim WR et al: Oncolytic vaccinia virus reinvigorates peritoneal immunity and cooperates with immune checkpoint inhibitor to suppress peritoneal carcinomatosis in colon cancer. J Immunother Cancer 2020, 8(2). 10.Nakao S, Arai Y, Tasaki M, Yamashita M, Murakami R, Kawase T, Amino N, Nakatake M, Kurosaki H, Mori M et al: Intratumoral expression of IL-7 and IL-12 using an oncolytic virus increases systemic sensitivity to immune checkpoint blockade. Sci Transl Med 2020, 12(526). 11.Zuo S, Wei M, Xu T, Kong L, He B, Wang S, Wang S, Wu J, Dong J, Wei J: An engineered oncolytic vaccinia virus encoding a single-chain variable fragment against TIGIT induces effective antitumor immunity and synergizes with PD-1 or LAG-3 blockade. J Immunother Cancer 2021, 9(12). 责任编辑丨谭硕 |