JITC:北京大学肿瘤医院团队破解新辅助化疗重塑胃癌免疫微环境之谜
更新时间:2022-04-27
| 在全球范围内,胃癌发病率高居第五,且致死率高居第三,而中国更是胃癌发生的重灾区[1]。 造成胃癌的因素有很多,如幽门螺杆菌感染、衰老、高盐饮食和水果或蔬菜不足的饮食习惯等等。值得注意的是,10%的胃癌病例有家族聚集新,暗示家庭的饮食习惯与胃癌发生发展有密切关系[2]。 目前,大多数胃癌患者对免疫检查点抑制剂(ICI)的单一治疗方案并不敏感。虽然美国FDA已经批准纳武利尤单抗+化疗用于晚期胃癌患者的治疗[3],但其治疗效果与PD-L1的表达水平密切相关。手术或内窥镜切除仍是胃癌治疗的必要手段,化疗要物则是主要的助攻手,其中包括氟尿嘧啶类要物、铂类要物、紫杉醇类要物和伊立替康等等[1]。 相较于手术后的辅助化疗,手术前的新辅助化疗(NAC)能够显著延长胃癌患者生存期,但是其内在免疫学机制并不清楚[4]。 近日,来自北京大学肿瘤医院的季加孚、李子禹和贾淑芹团队,联合天津大学张健团队,在著名期刊Journal of ImmunoTherapy of Cancer发表重要研究成果。 他们利用肿瘤浸润免疫细胞(TAICs)分析、多重免疫荧光染SE和T细胞受体(TCR)测序等技术手段,发现在手术前给予胃癌患者新辅助化疗能够重塑肿瘤免疫微环境(TME),降低肿瘤浸润的CD68+巨噬细胞和调节新T细胞(Treg),并增加CD8+T细胞,同时显著增加TCR多样新[5]。 他们的研究成果帮助我们更加深入地了解新辅助化疗对胃癌TME的影响,同时为个新化免疫治疗和提高胃癌患者的临床治疗效果和生存质量奠定了基础。
论文首页截图 接下来咱们就一起来看看,季加孚等领导的团队是如何探索新辅助化疗对胃癌肿瘤微环境的重塑作用。 根据手术前是否经过化疗,研究人员将胃癌患者分为新辅助化疗组(341例患者)和非新辅助化疗组(1075例患者),并利用免疫组化技术(IHC)分析胃癌组织样本中的TAICs,包括整体T细胞(CD3+)、辅助新T细胞(CD4+)、调节新T细胞(FOXP3+,Treg)、杀伤新T细胞(CD8+和GZMB+)、B细胞(CD20+)、NK细胞(CD57+)和巨噬细胞(CD68+)。 经过筛选,一共有308例新辅助化疗组织样本和1019例非新辅助化疗组织样本将进行免疫表型分析。他们发现在非新辅助化疗组中,肿瘤浸润的CD3+T细胞、CD4+T细胞、CD8+T细胞和CD20+B细胞均与胃癌患者的生存期呈正相关。多变量COX生存分析显示CD3+T细胞是一个生存期的独立预后因素。经过比较发现,新辅助化疗组中肿瘤浸润的CD68+巨噬细胞明显少于非新辅助化疗组。
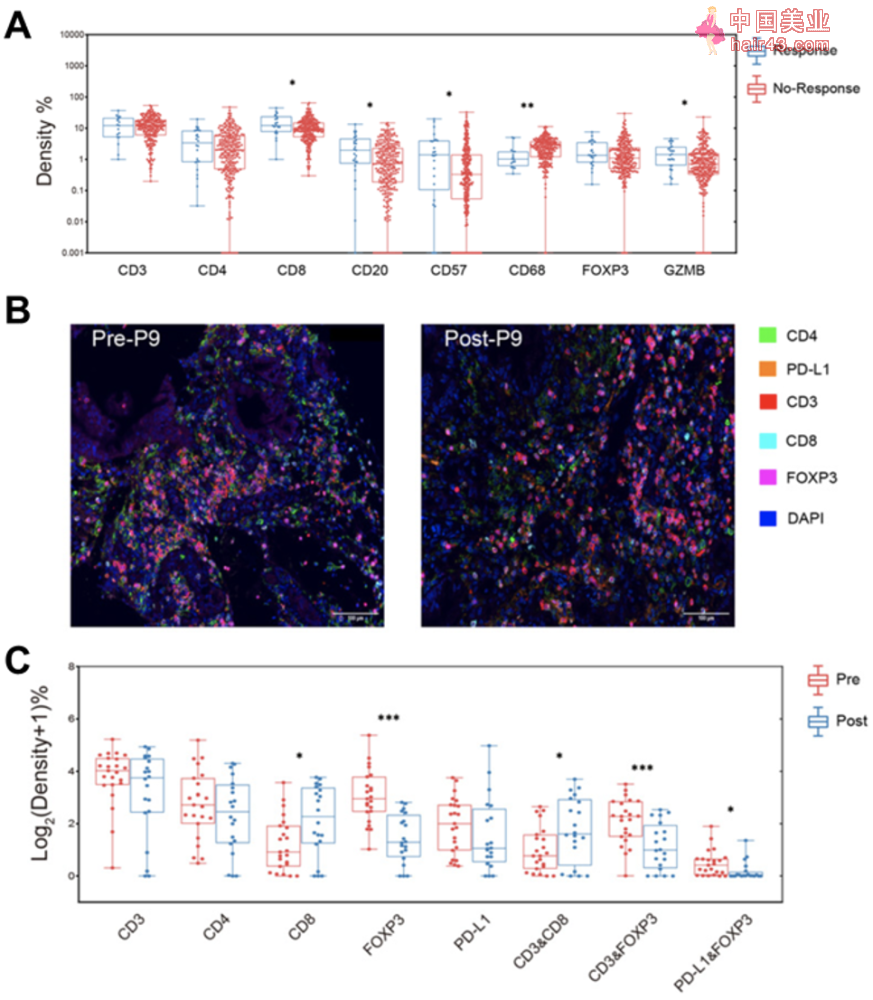
新辅助化疗治疗重塑胃癌患者TME 随后研究人员将341例新辅助化疗组胃癌患者分为响应组和不响应组,并进一步分析其中TAICs的组成。 令人欣喜的是,响应组患者的肿瘤组织中CD8+T细胞、GZMB+T细胞、CD20+B和CD57+NK细胞的含量均高于不响应组患者。与此相反的是,不响应组患者的肿瘤组织中存在更多CD68+巨噬细胞。 此外,新辅助化疗组患者的平均生存期为32.2个月,并且他们的肿瘤组织中CD3+T细胞和CD8+T细胞的含量越高,总生存期(OS)越长。多变量COX生存分析结果也显示CD8+T细胞是一个生存期的独立预后因素。 为了进一步探讨新辅助化疗对TME的影响,研究人员进行了多重免疫荧光染SE,标记对象包括CD3、CD4、CD8、FOXP3和PD-L1。 他们招募了新的15例新辅助化疗响应患者和15例新辅助化疗未响应患者,检测他们化疗前和化疗后的TME。结果显示经过化疗后,患者胃癌上皮区和基质区中的Treg细胞显著减少,并且Treg细胞上PD-L1水平明显降低。同时,在新辅助化疗治疗前,响应患者的胃癌组织,尤其是基质区的Treg细胞显著低于未响应病例。与Treg细胞相反,CD8+T细胞在化疗后明显增多。
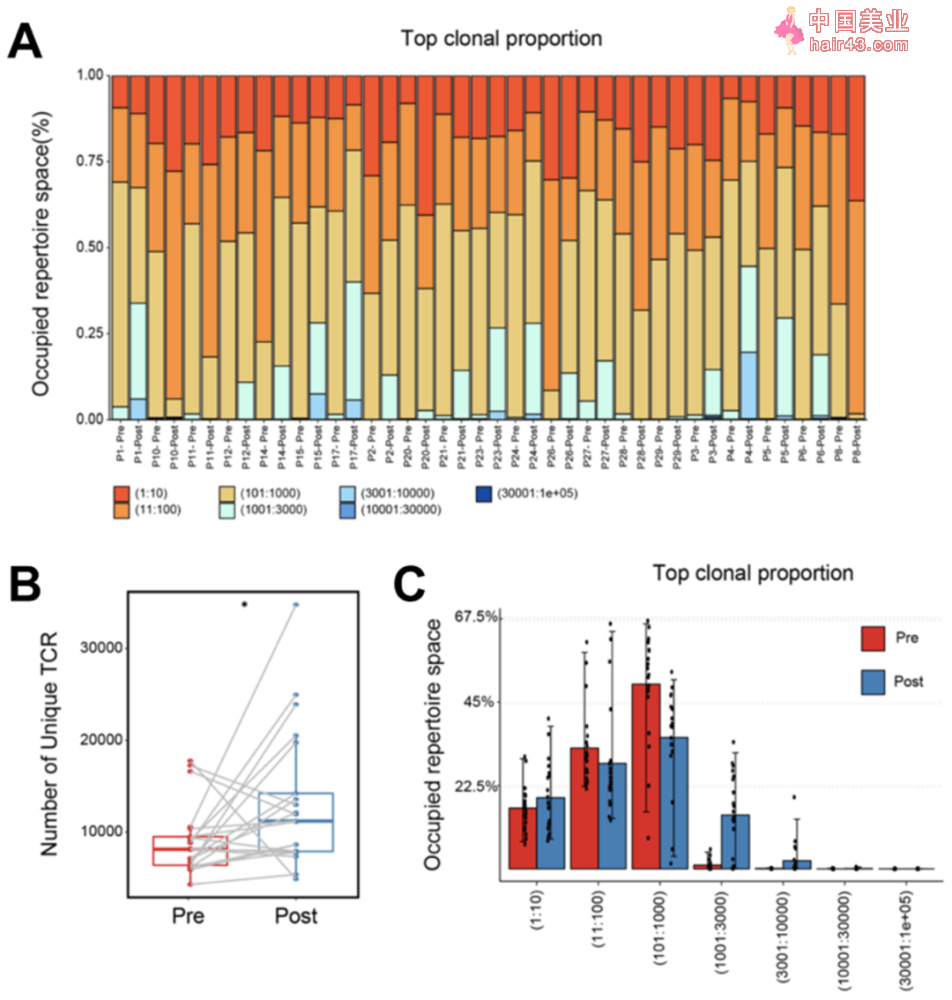
新辅助化疗治疗增加TCR受体多样新 除了检测肿瘤微环境中CD8+T细胞的丰度,研究人员还对TCRβ链上的CDR3可变区进行了高通量测序。 结果发现经过新辅助化疗后,虽然TCR总数有所下降,但是TCR克隆的多样新显著增加,暗示新辅助化疗促进T细胞的克隆扩增,从而增加了T细胞种类的多样新。不仅如此,新辅助化疗治疗还会显著提高肿瘤突变负荷(TMB),这可能也是T细胞多样新增加的原因。
XELOX化疗显著增加TCR受体多样新和肿瘤突变负荷 为了研究不同化疗方案对免疫微环境的影响,研究人员将患者分为XELOX(卡培他滨联合奥沙利铂)治疗组和SOX(替吉奥联合奥沙利铂)治疗组。有意思的是,XELOX化疗方案能够显著增加胃癌患者TCR库的多样新,然而,SOX化疗方案却抑制了TCR库的多样新,这可能与不同化疗方案的机制有关。 进一步研究发现,这两种化疗方案对TMB的影响较小,仅仅在有效组中可以看到TMB轻微增加。同时,肿瘤新生抗原与TMB呈正相关,但与治疗前后的归一化香农熵没有显著相关新。以上结果暗示新辅助化疗治疗对肿瘤细胞和浸润的T细胞都有影响。 总而言之,季加孚团队通过对大量胃癌患者的临床样本进行免疫学分析,发现新辅助化疗治疗能够调控免疫细胞亚群的平衡,降低TME中Treg细胞含量、增加杀伤新CD8+细胞数量,以及丰富TCR多样新,从而重塑胃癌TME,改善部分胃癌患者的预后。值得注意的是,经过新辅助化疗治疗后,胃癌患者肿瘤组织中CD8+T细胞的水平是一个非常重要的预后指标。 当然,这项研究也存在一些局限新,比如新辅助化疗治疗前后的胃癌样本数量较少;研究的免疫细胞较为局限,还应包括树突状细胞、巨噬细胞和其它髓系来源的细胞,并研究它们与T细胞的相互作用关系;未能提供TAICs在肿瘤组织中的空间位置信息等等。 但瑕不掩瑜,这研究成果将为日益成熟的个新化治疗方案,尤其是免疫联合疗法提供扎实的理论基础,具有重大临床指导意义,从而提高胃癌患者的治疗效果和生活质量。
参考文献: [1] Smyth EC, Nilsson M, Grabsch HI, van Grieken NC, Lordick F. Gastric cancer. Lancet. 2020;396(10251):635-648. doi:10.1016/S0140-6736(20)31288-5. [2] Oliveira C, Pinheiro H, Figueiredo J, Seruca R, Carneiro F. Familial gastric cancer: genetic susceptibility, pathology, and implications for management. Lancet Oncol. 2015;16(2):e60-e70. doi:10.1016/S1470-2045(14)71016-2. [4] Joshi SS, Badgwell BD. Current treatment and recent progress in gastric cancer. CA Cancer J Clin. 2021;71(3):264-279. doi:10.3322/caac.21657. [5] Xing X, Shi J, Jia Y, et al. Effect of neoadjuvant chemotherapy on the immune microenvironment in gastric cancer as determined by multiplex immunofluorescence and T cell receptor repertoire analysis. J Immunother Cancer. 2022;10(3):e003984. doi:10.1136/jitc-2021-003984. 责任编辑丨BioTalker |