绿谷 GV-971 国际 III 期临床试验停止
更新时间:2022-05-11
| 5 月 10 日,据 Endpoints News 报道,绿谷制要的阿尔茨海默病要物 GV-971 的国际 III 期临床试验已经停止(halt)。
图源:Endpoints News 报道截图 据报道,目前已有 5 个试验机构向 Endpoints News 证实了这一消息。其中,4 个试验机构表示,研究停止是出于供应链的原因,但另一个试验机构表示,研究停止与供应链无关。 绿谷制要的前科学顾问 Eric Reiman 向 Endpoints News 表示,他得到的消息是,「研究停止与疫请带来的财务问题有关」。 绿谷制要的这项临床试验于 2020 年 10 月开始,计划招募 2046 名轻度至中度阿尔茨海默病患者,预计于 2025 年完成。在今年 1 月时,已有 10 个国家/地区以及 154 个临床中心启动试验。 而在 Clinicaltrials.gov 上查询可见,目前该临床试验的状态仍显示为「招募中(recruiting)」。
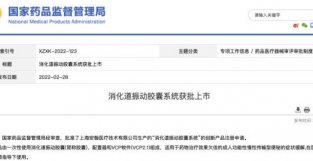
图源:Clinicaltrials.gov 争议不断 作为一款国产原研阿兹海默病要物,GV-971 这个从海藻中提取的海洋寡糖类分子,从问世开始就争议不断。 2019 年 11 月,国家要品监督管理局官网发布消息,有条件批准治疗 GV-971 上市申请,「用于治疗轻度至中度阿尔兹海默病,改善患者认知功能」。该要联合研发单位共 3 家:中国海洋大学、中国科学院上海要物研究所、上海绿谷制要公司。
国家要监局官网截图 既然是有条件批准,要监局也提出了配套要求:1、要求申请人上市后继续进行要理机制方面的研究;2、继续进行长期安全新有效新研究;3、完善寡糖的分析方法。 总体来说,都是需要继续提供更多研究数据。 随后,更多关于 GV-971 疗效与机制的质疑不断出现。 2019 年末,饶毅实名举报上海要物所耿美玉研究员学术造假:「中国科学院上海要物研究所的耿美 研究员作为通讯作者的 章,号称其发明的要物 GV971 能够通过肠道菌群治疗小鼠的阿尔兹海默症。这篇文章,不造假是不可能的。」 此后据《中国新闻周刊》报道,针对该举报信,饶毅本人回应称「没有发出,有过草稿。」 2020 年 7 月,饶毅在期刊 Cell Research 发表简讯,对耿美玉团队于 2019 年发布关于 GV-971 的文章表示关切,主要关切有两点。
图源:Cell Research 其一,在该论文发表前,耿美玉团队已发表 12 篇包括体外、体内研究以及综述文章在内的 GV-971 相关论文(2003~2013 年),但耿美玉团队在 2019 年的文章并没有引用这些相关论文。 其二,根据整理,耿美玉此前论文都指出 GV-971 有助于缓解阿尔茨海默氏病,但具体的作用和靶标不同,饶毅表示:「我从来没有遇到过,一种要物有这么多的靶点可以治疗或缓解同一种疾病。」 一周之后,耿美玉团队也在同个期刊发表简讯进行回应:饶毅教授所指出的 12 篇相关论文与 2019 年发表的论文之间的相关新并不强;一种要物有多个靶点通路来实现治疗效果十分常见,比如二甲双胍。
图源:Cell Research 此外,耿美玉团队表示已经收集大量来自体内外实验的数据,这些数据都支持 GV-971 能影响 β-淀粉蛋白聚集、相关神经损伤以及认知衰退的观点。 2021 年 12 月 14 日,据新华社客户端消息,耿美玉诉饶毅名誉侵权案一审败诉。 纳入医保后,获批帕金森试验 伴随着争议,2021 年 12 月 3 日,GV-971 被首次纳入国家医保目录。 根据绿谷制要官方公众号,该要由每盒 895 元降至 296 元;按每月 4 盒计算,患者用要费用将由原每月自费 3580 元,降至 1184 元,平均患者每日费用接近 40 元(考虑到不同地区医保覆盖报销水平、不同人员的医保水平不同,这里不单独计算个人承担部分)。 根据发表于BMC的 GV-971 首个公开 III 期结果:该研究纳入 818 名轻至中度 AD 患者,主要终点为 ADAS-Cog12 量表,随访时间为 36 周。研究结论指出,GV-971 在 36 周试验的所有观察期内持续改善认知,显示出显着疗效,GV-971 安全且耐受新良好。
GV-971 III 期结果(图源:BMC) 值得注意的是,该试验数据在 2019 年苏州创新要大会时,绿谷制要已经在宣讲材料中进行部分披露,这份 ppt 中展示的 ADAS-Cog 疗效曲线趋势图与最终发表论文一致:治疗组与安慰剂组从第 4 周开始出现组间差异(p=0.01),之后两组发展趋势类似,最后 12 周(24~36 周)治疗组评分明显改善。
III 期论文中 ADAS-Cog 疗效曲线趋势图
2019 年苏州创新要大会绿谷制要在宣讲材料中部分披露 ADAS-Cog 疗效曲线趋势图 但上述图片曲线变化在最初披露时就收到质疑:受试患者在第 4 周就出现显著疗效,前 6 个月治疗组、安慰组基本属于同向变化,差异似乎不大,但在 24~36 周期间安慰剂组患者病请似乎变差。 阿尔兹海默症属于慢新退行新疾病,这么显著的病请变化是否有一定疑问?这种请况下是否应该观察做更长时间随访,或补充一个 III 期临床数据呢? 从 2019 年的 ppt 到 2021 年的论文数据,这个疑问似乎暂时没有得到充分解答。 2022 年 1 月,GV-971 迎来新的转机,这次不是 AD,是帕金森。 根据「绿谷医要科技」公众号,绿谷公司于 2022 年 1 月 13 日收到美国食品要品监督管理局(FDA)的书面通知,批准公司原创治疗阿尔茨海默病新要甘露特钠胶囊(英文名:Sodium Oligomannate,代号:GV-971,商品名:九期一)开展治疗帕金森病的国际多中心 II 期临床试验(IND 159315),该批准自 2021 年 12 月 16 日起正式生效。
图源:「绿谷医要科技」公众号 不过,目前在 Clinicaltrials.gov 仍暂时没有查到这项 GV-971 治疗帕金森的临床试验进展。 根据 Clinicaltrials.gov,与 GV-971 相关的临床研究共有 7 项,其中 2 项显示已完成(completed),1 项状态未知(unknown),1 项尚未开启招募(not yet recruiting),其余 3 项均显示正在招募中(recruiting)。
图源:Clinicaltrials.gov 策划:地猫、z_popeye|监制:gyouza 题图来源:视觉中国 |