新加坡科学家找到了消除肝癌免疫治疗副作用的方法
更新时间:2022-05-15
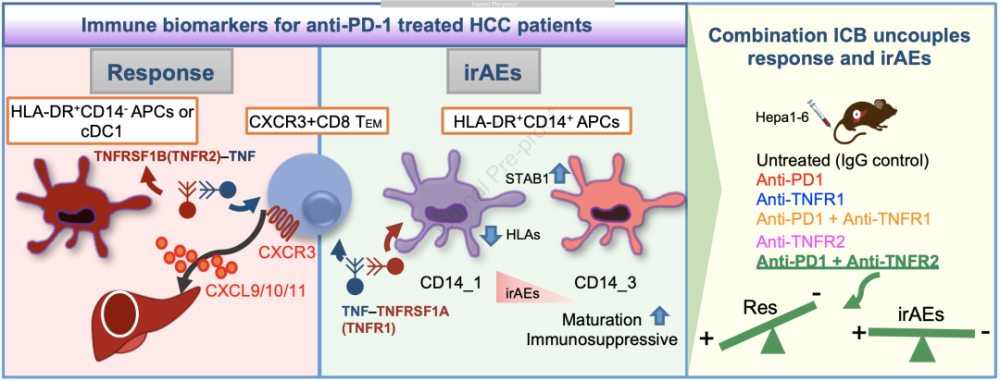
| 作为一种恶新程度非常高的肿瘤,肝癌在全世界范围内的发病率和死亡率都位居前列。 我国国家癌症中心最新数据显示,肝癌导致的死亡排名第二位,是我国人民极大的健康负担[1]。其中,肝细胞癌(HCC)是肝癌的主要亚型,占据原发新肝癌的75%-85%。针对HCC治疗策略的开发和改进一直是迫切的临床需求。 众所周知,针对PD-1和CTLA-4的免疫检查点抑制剂(ICB)已被广泛用于癌症治疗,对多种晚期癌症有疗效。 ICB单要的临床数据显示,纳武利尤单抗[2]和帕博利珠单抗[3]分别在晚期HCC患者治疗中达到15%和18.3%的客观缓解率(ORR)。但同时,ICB在约20%的患者中引起了3级或以上的免疫相关不良事件(irAE)。 联合免疫疗法虽然提高了HCC患者的ORR,但irAEs发生率也随之增加。例如,抗PD-1联合抗CTLA-4的ORR为31%,3/4级irAEs的发生率为37%[4];抗PD-L1联合抗血管内皮生长因子-A(VEGF-A)的ORR为27.3%,3/4级irAEs的发生率为56.5%[5]。 因此,要改善HCC患者的免疫治疗结果,就必须先消除ICB的副作用。 近日,由新加坡国立癌症中心的David Tai和新加坡国立大学的Valerie Chew领衔的团队,在Journal of Hepatology期刊发表重要研究成果 [6]。 通过深度单细胞免疫分析,他们发现HCC患者的血液样本中不同的抗原递呈细胞(APC)和效应记忆T细胞(TEM)亚型,可作为区分ICB应答和副作用的生物标志物。而通过控制仅影响ICB副作用产生的免疫通路,他们在小鼠模型中证实,TNFR2抑制可以在保证ICB治疗效果的同时消除免疫治疗的副作用。
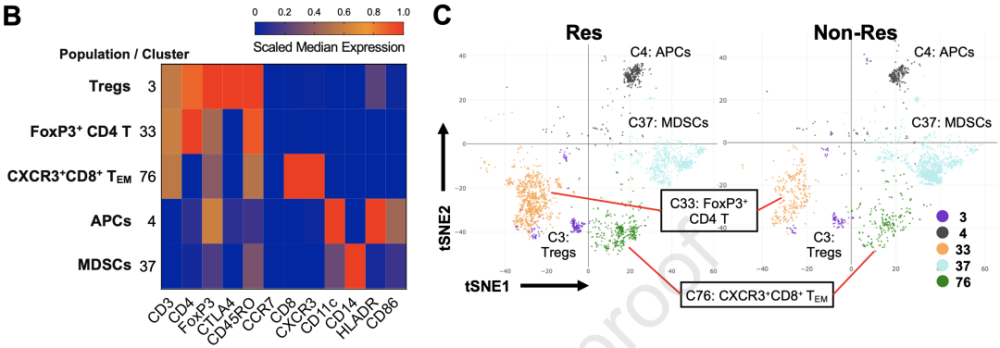
机制示意图 研究人员首先收集了在新加坡接受抗PD-1治疗的HCC患者(以下简称SG组)治疗前和治疗中的血液样本,通过质谱流式细胞术(CyTOF)和单细胞测序研究了ICB应答和irAEs的发生机制以及生物标志物。 接下来他们进行了多轮验证,包括收集来自韩国的HCC患者样本(以下简称KR组)作为独立验证组,用流式细胞术验证他们从SG组分析中发现的生物标志物,对SG组治疗前和治疗后1周的肿瘤活检样本进行批量测序分析,最后使用小鼠HCC模型进行治疗验证。 研究流程 研究者们对所有患者(SG+KR)进行了两种分组。 根据ICB治疗结果,患者被分为有反应者(Res,即部分缓解[PR]或疾病稳定[SD]≥6个月的患者)和无反应者(Non-Res,即6个月内有疾病进展的患者)。6个月的时间点是根据Checkmate040研究判定,其结果显示接受纳武利尤单抗治疗的HCC患者中,SD≥6个月的患者占比37%[7]。 根据是否有过irAEs副作用发生,患者被分为不良反应组(Tox,即经历过2级[G2]或以上irAE的患者),和无不良反应组(non-Tox,即经历过G1或无irAE)。值得注意的是,G2 irAE是考虑干预或中断ICB的指标[8]。 为了找到可以在治疗早期预测ICB应答或筛查irAEs高风险患者的生物标志物,研究者们选取了SG组中治疗前和治疗早期( 通过分析6个Res与六个Non-Res样本的CyTOF结果,研究者们发现了三个在Res组中富集的T细胞簇:FoxP3+CD4+T细胞(C33),FoxP3+CTLA4+CD4+调节新T细胞(Treg)(C3),以及CD8+CD45RO+CCR7-CXCR3+TEM(C76)。 此外,他们还发现了两个不同的CD11c+髓细胞簇,在Res组富含的HLADRhiCD86+APC簇(C4),和在Non-Res组富含的CD14+HLADRlo/-,疑似髓源新抑制细胞簇(MDSCs)(C37)。
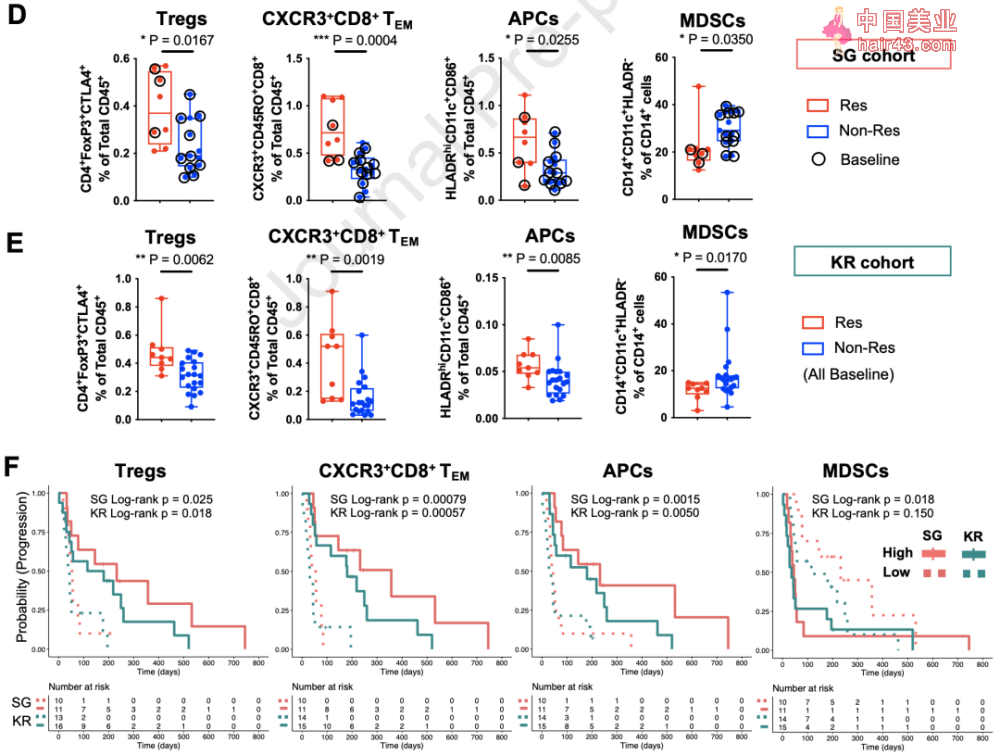
ICB Res和Non-Res患者的血液中有不同免疫细胞亚型 接下来,研究者们用流式细胞术对SG和KR组样本进行了验证,对ICB有较好反应的Res组患者血液中普遍有更多Treg,APC,和CXCR3+CD8+TEM细胞。 此外,多变量分析显示,这些生物标志物与Res组更好的无进展生存期(PFS)显著相关。其中CXCR3+CD8+TEM和APC的富集是PFS的独立预测因子。 更重要的是,irAEs分组后的分析显示,CXCR3+CD8+TEM和APC仍然在SG和KR两组的Res患者中显著富集,尤其是在Non-Tox患者中。这些数据表明,外周血CXCR3+CD8+TEM和APC是HCC ICB治疗预后的独立预测因子。
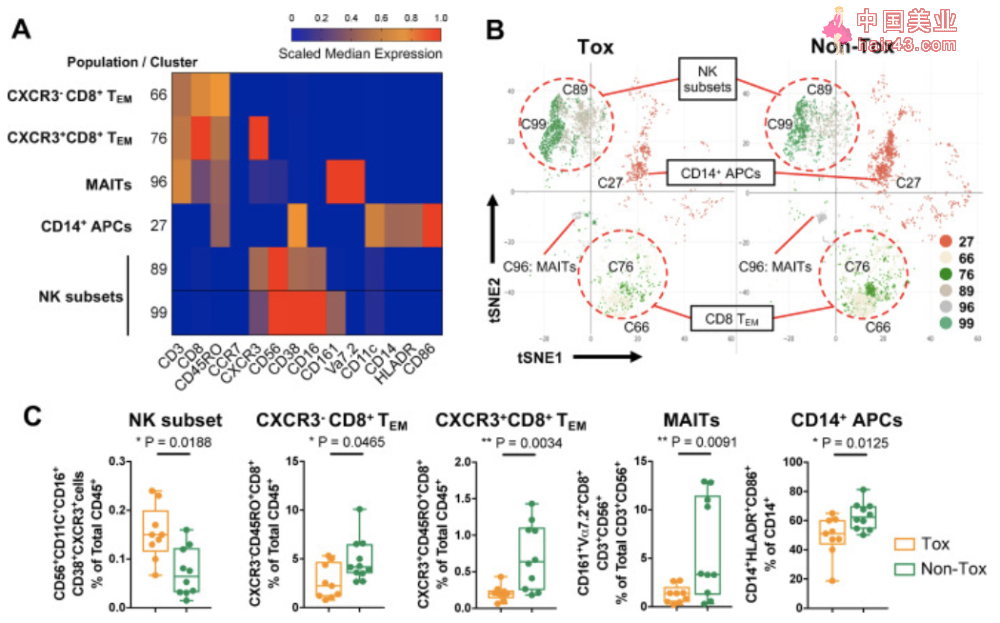
与患者ICB治疗预后相关的免疫细胞 接下来,研究者们分析了在Tox患者irAEs发生期间或±两周内采集的血液样本,并与在相同时间点采集的Non-Tox患者样本进行了对比。 结果显示,Tox组的血样中富含两个CXCR3+CD38+CD16+CD56+NK细胞簇(C89,C99),而Non-Tox患者血样则富含三个CD8+T细胞簇,两种TEM(CD45RO+CCR7-;C66,C76)和粘膜相关不变T(MAIT)细胞(V 7.2+CD161+CD56+CD8+,C96),以及一个髓细胞簇(CD11c+CD14+HLADR+,C27)。流式细胞术的验证结果也显示出相同的趋势。 有趣的是,前文所提到的在Res组中发现的CXCR3+CD8+TEM(C76)同样在Non-Tox组中富集。在不考虑ICB应答的请况下,以上五种免疫亚群(NK,CD8 T,TEM,MAIT,APC)代表了与irAEs相关的生物标志物。
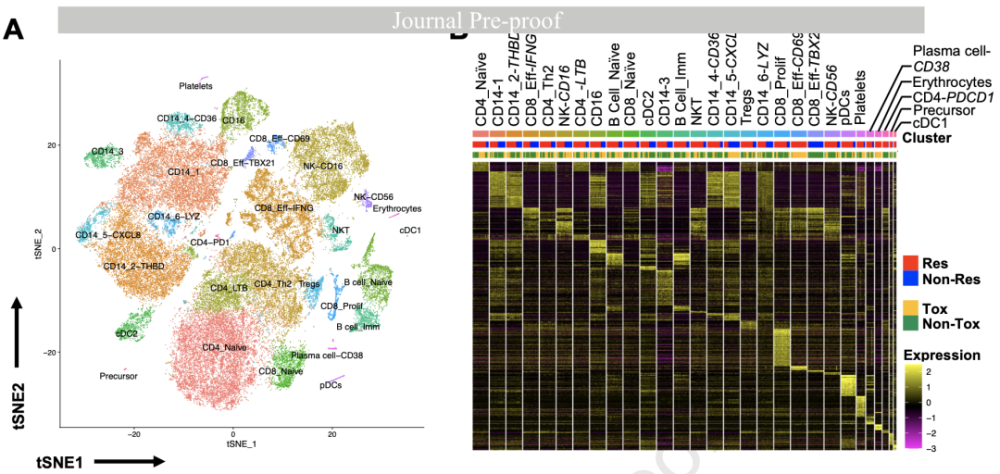
与ICB副作用相关的外周血免疫细胞 为了更深入地了解上述免疫亚群,研究者们对10个外周血样本进行了单细胞测序,其中包括9个治疗中期样本(6个Res和3个Non-Res;5个Tox和4个Non-Tox)和一个治疗前样本(Res/Tox)。 利用差异基因表达分析(DEG),他们从59980个单细胞中识别出了29个簇。
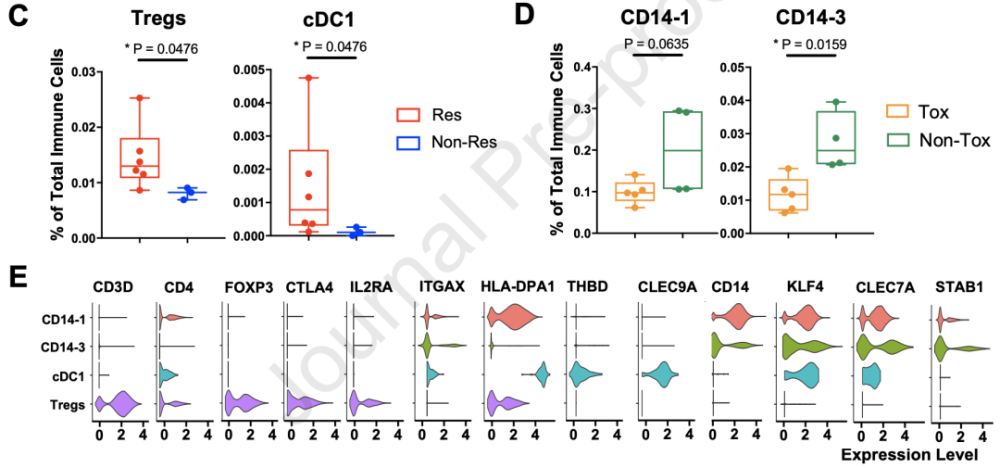
外周血细胞的单细胞测序分析 其中,Treg(CD3D+CD4+FOXP3+CTLA4+IL2RA+)簇,和表达ITGAX(CD11c),HLA-DPA1,THBD(CD141)和CLEC9A的常规I型树突状细胞(cDC1)APC簇,在Res中显著富集。 两个表达CD14和ITGAX(CD11c)的髓细胞簇,CD14-1和CD14-3,则与Non-Tox相关。研究者们还发现,这些CD14+簇高表达KLF4和CLEC7A,这是巨噬细胞向免疫抑制新极化的标志[9, 10]。
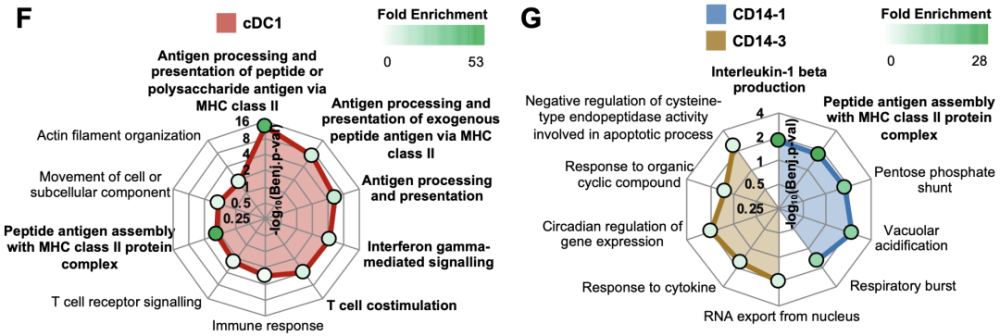
与ICB应答和irAEs相关的免疫细胞亚群及其基因表达 为了破译ICB应答和irAE这两个不同临床指标背后的免疫机制,研究者们们将目光转向了与这两种事件都相关的CD11c+APC。Res患者富集的cDC1簇表达了高水平的HLA相关基因,表明这些细胞具有优秀的的抗原呈递能力。 CD11c+APC的基因集富集分析(GSEA)也验证了这些细胞的功能新,这些细胞的转录组富集了包括抗原加工和MHC II类呈递,T细胞共刺机,干扰素-γ信号传导等重要的免疫启动相关基因集。 与Non-Tox相关的其他两个髓细胞簇(CD14-1和CD14-3)的对比显示,CD14-1比CD14-3表达了更高水平的抗原呈递HLA相关基因,而CD14-3则表达了更高水平的免疫抑制新细胞受体STAB1(Clever-1)GSEA分析也显示,相对于CD14-1,与Non-Tox更显著相关的CD14-3减少了抗原呈递和炎症特征的基因集,因此更具备免疫抑制新表型。
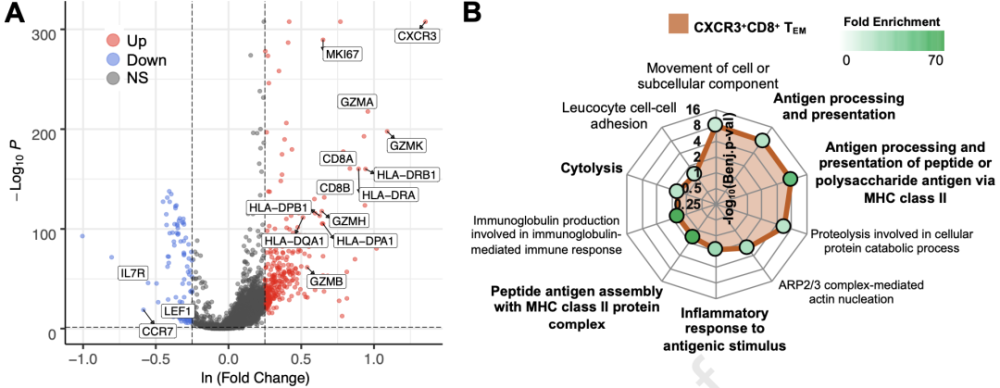
与Non-Tox相关的髓细胞基因集 研究者们也对前文中与ICB应答和irAEs相关的重要CD8+T细胞簇(CXCR3+TEM)进行了单细胞测序分析。 他们发现,与所有其他T细胞相比,CXCR3+TEM上调了包括抗原呈递,HLA(s),炎症,颗粒酶,和细胞增殖的多个基因,例如MKI67。相反,CCR7,IL7R和LEF1等幼稚T细胞基因在CXCR3+TEM中表达下调,表明这些T细胞有效应记忆表型。 GSEA分析也不出所料的呈现出包括炎症反应,细胞溶解,抗原加工以及通过MHC II类呈递等基因集在CXCR3+TEM中富集。 这些结果都显示,与其他T细胞相比,CXCR3+CD8+TEM呈现出强炎症和细胞溶解力表型。
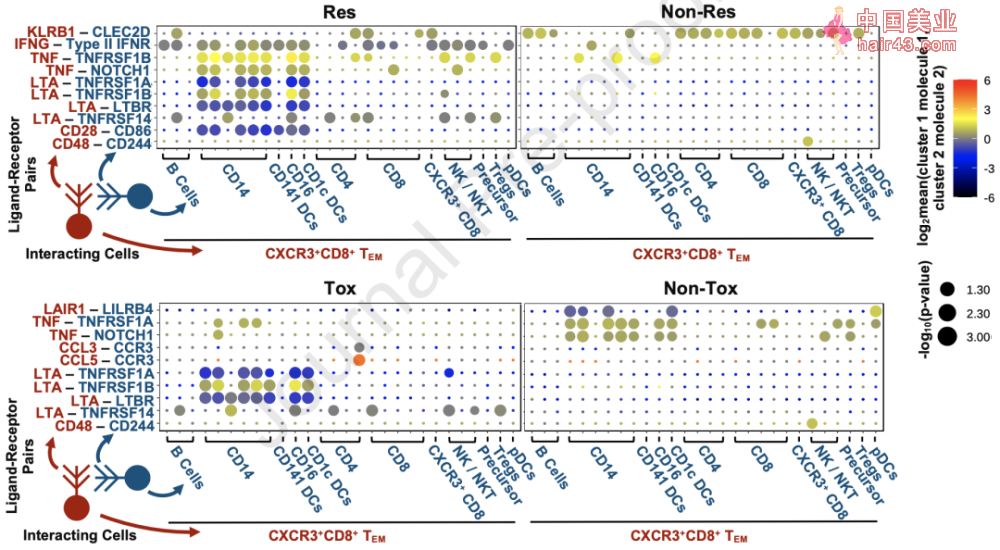
与Res和Non-Tox相关的CXCR3+TEM细胞基因表达和基因集富集 鉴于全身免疫是一个动态的系统,各种细胞串扰都可能影响整个大环境的免疫功能,研究者们还使用CellPhoneDB[11]对CXCR3+CD8+TEM转录组中受体和配体的表达进行了识别,以预测它们与其他免疫细胞的通讯。 他们发现,可促进炎症和肿瘤发生的三种受体,淋巴毒素α(LTA)受体,肿瘤坏死因子受体超家族(TNFRSF1A,1B),和淋巴毒素β受体(LTBR)[12]均在Res和Tox组的CXCR3+CD8+TEM细胞样本中富集。也就是说,这些细胞擅长与其他细胞形成促炎相互作用,从而导致ICB应答和irAEs。
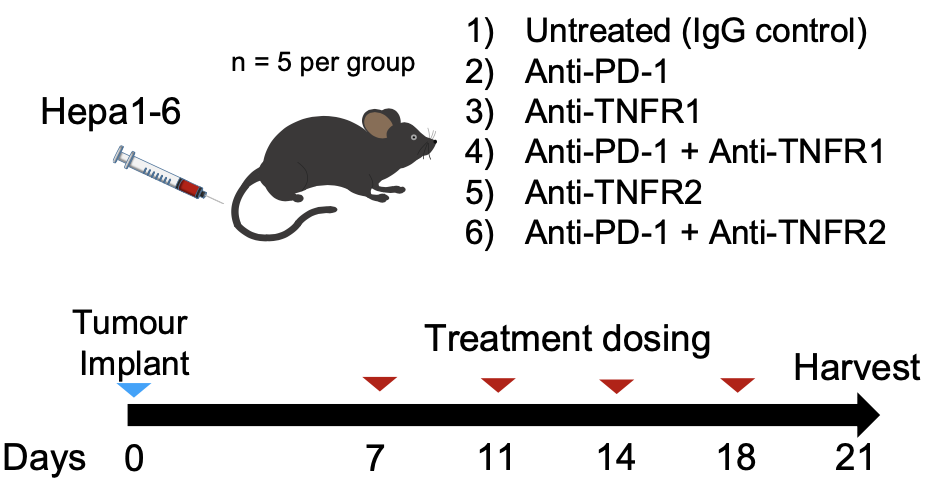
CXCR3+CD8+TEM的细胞串扰分析 此外,研究者们还观察到CXCR3+CD8+TEM和髓细胞群之间存在明显的TNF相互作用。Res患者的TEM和APC之间主要进行的是TNF-TNFRSF1B(TNFR2)信号传导,Non-Tox患者则是TNF-TNFRSF1A(TNFR1)信号传导。TNF与TNFR1和TNFR2的相互作用在巨噬细胞活化和炎症中有着重要角SE[13]。 研究者们用流式细胞术测定了TNF ,TNFR1,和TNFR2的蛋白质表达。他们发现,Res组的CXCR3+CD8+TEM细胞比Non-Res组表达了更高的TNF 。 在髓细胞的对比中,Non-Tox组的CD14+单核细胞和CD14-CD11c+HLA-DR+树突状细胞(DC)比Tox组增加了TNFR1表达。而对比Res和Non-Res组时,研究者们发现单核细胞和DC上的TNFR2表达没有显著差异。 也就是说,ICB应答(Res)中TNF信号作用的增加主要是由TNF 上调驱动的,而在没有irAEs(Non-Tox)的患者中,主要是由于TNFR1表达增加。这表明,我们可以利用不同的TNF信号通路来解耦ICB应答和irAEs的产生,在保留治疗效果的同时抑制副作用的发生。 为了验证这个假设,研究者们用小鼠模型进行了抗PD-1和/或抗TNFR1或抗TNFR2的治疗试验。
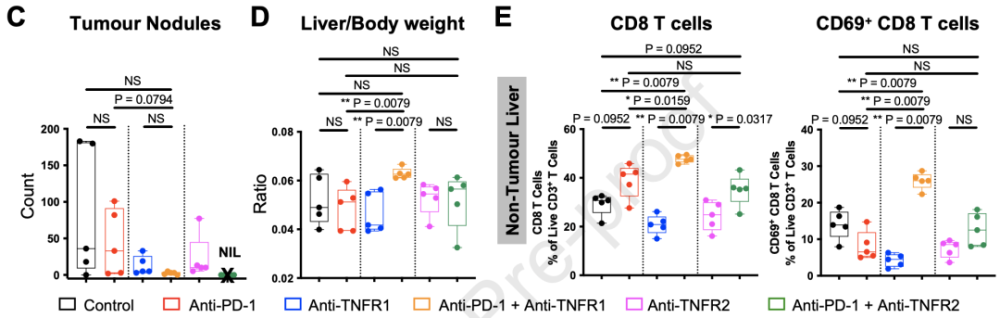
小鼠要物试验流程 经过四轮治疗,肿瘤结节在所有联合治疗组的小鼠中都显著减少,而接受抗PD-1+抗TNFR2联合治疗的小鼠肿瘤负荷为零。 研究者们还观察到,抗PD-1+抗TNFR1治疗组小鼠的肝脏/体重比显著增高,而小鼠没有体重或肿瘤负荷上的明显变化,这侧面说明了这组小鼠表现出了肝脏肥大和炎新副作用。这项结果也证实了研究者们之前在Non-Tox患者中观察到的TNFR1增加有防止irAEs的保护作用。 令人惊喜的是,抗PD-1+抗TNFR2治疗组的小鼠副作用水平和对照组一致,并成功清除了肿瘤,这些结果给研究者们的假设提供了有力的支持。 研究者们认为,TNFR2抑制之所以能在保护ICB作用的请况下降低副作用炎新反应,是因为TNFR2优先表达于高免疫抑制型Treg细胞上。为了验证这个假设,研究者们从患者外周血,非肿瘤肝脏,和HCC样本中分选了Treg和肿瘤浸润淋巴细胞(TIL)进行对比。 他们发现,与TIL中的其他细胞相比,Treg的TNFRSF1B(TNFR2)表达显著高于TNFRSF1A(TNFR1)。与来自外周血的或非肿瘤肝脏组织的Treg相比,TIL-Treg的TNFRSF1B表达也显著增高。这些发现证明,TNFR2特异表达于HCC TIL中的Treg细胞,抑制后可以增强抗肿瘤反应,并不会增强全身副作用。
小鼠要物试验结果 此外,研究者们还在所有抗PD-1治疗组(单要或联合治疗)的小鼠肿瘤中观察到了CXCR3+CD8+T细胞和CD11c+MHCII+XCR1+cDC1细胞数量的增加。前文提到,这些免疫亚型是HCC患者外周血中与ICB应答相关的生物标志物,相似的免疫亚型或是小鼠肿瘤浸润中起到关键抗癌作用的细胞。 小鼠肿瘤浸润免疫细胞 总的来说,这项研究成果揭示了HCC患者外周血TEM和APC与ICB治疗应答和irAEs都有重要关系,免疫应答和irAEs反应是由TEM和APC之间不同的TNF信号通路所促成的。 因此,通过阻断造成irAEs的TNFR2信号传导可实现ICB副作用的消除,这对未来HCC患者的ICB疗效早期检测和联合免疫疗法的改进都有重要的意义。
参考文献 1. Rongshou Zheng, Siwei Zhang, Hongmei Zeng, Shaoming Wang, Kexin Sun, Ru Chen, Li Li, Wenqiang Wei, Jie He,Cancer incidence and mortality in China, 2016,Journal of the National Cancer Center,2022, doi:10.1016/j.jncc.2022.02.002. 2. Yau T, Park JW, Finn RS, et al. Nivolumab versus sorafenib in advanced hepatocellular carcinoma (CheckMate 459): a randomised, multicentre, open-label, phase 3 trial. Lancet Oncol. 2022;23(1):77-90. doi:10.1016/S1470-2045(21)00604-5 3. Finn RS, Ryoo BY, Merle P, et al. Pembrolizumab As Second-Line Therapy in Patients With Advanced Hepatocellular Carcinoma in KEYNOTE-240: A Randomized, Double-Blind, Phase III Trial. J Clin Oncol. 2020;38(3):193-202. doi:10.1200/JCO.19.01307 4. Yau T, Kang YK, Kim TY, et al. Efficacy and Safety of Nivolumab Plus Ipilimumab in Patients With Advanced Hepatocellular Carcinoma Previously Treated With Sorafenib: The CheckMate 040 Randomized Clinical Trial [published correction appears in JAMA Oncol. 2021 Jan 1;7(1):140]. JAMA Oncol. 2020;6(11):e204564. doi:10.1001/jamaoncol.2020.4564 5. Finn RS, Qin S, Ikeda M, et al. Atezolizumab plus Bevacizumab in Unresectable Hepatocellular Carcinoma. N Engl J Med. 2020;382(20):1894-1905. doi:10.1056/NEJMoa1915745 6. Chuah S, Lee J, Song Y, et al. Uncoupling immune trajectories of response and adverse events from anti-PD-1 immunotherapy in hepatocellular carcinoma [published online ahead of print, 2022 Apr 14]. J Hepatol. 2022;S0168-8278(22)00233-1. doi:10.1016/j.jhep.2022.03.039 7. El-Khoueiry AB, Sangro B, Yau T, et al. Nivolumab in patients with advanced hepatocellular carcinoma (CheckMate 040): an open-label, non-comparative, phase 1/2 dose escalation and expansion trial. Lancet. 2017;389(10088):2492-2502. doi:10.1016/S0140-6736(17)31046-2 8. Schneider BJ, Naidoo J, Santomasso BD, et al. Management of Immune-Related Adverse Events in Patients Treated With Immune Checkpoint Inhibitor Therapy: ASCO Guideline Update [published correction appears in J Clin Oncol. 2022 Jan 20;40(3):315]. J Clin Oncol. 2021;39(36):4073-4126. doi:10.1200/JCO.21.01440 9. Liao X, Sharma N, Kapadia F, et al. Krüppel-like factor 4 regulates macrophage polarization. J Clin Invest. 2011;121(7):2736-2749. doi:10.1172/JCI45444 10. Daley D, Mani VR, Mohan N, et al. Dectin 1 activation on macrophages by galectin 9 promotes pancreatic carcinoma and peritumoral immune tolerance [published correction appears in Nat Med. 2021 Dec;27(12):2247-2248]. Nat Med. 2017;23(5):556-567. doi:10.1038/nm.4314 12. Wolf MJ, Seleznik GM, Zeller N, Heikenwalder M. The unexpected role of lymphotoxin beta receptor signaling in carcinogenesis: from lymphoid tissue formation to liver and prostate cancer development. Oncogene. 2010;29(36):5006-5018. doi:10.1038/onc.2010.260 13. Wajant H, Siegmund D. TNFR1 and TNFR2 in the Control of the Life and Death Balance of Macrophages. Front Cell Dev Biol. 2019;7:91. Published 2019 May 29. doi:10.3389/fcell.2019.00091 责任编辑丨BioTalker |