定价不超1万,低于同类进口要物!首款国产新冠特效要上市,华润等为经销商
更新时间:2022-07-09
| 本文来源:时代财经 作者:李傲华
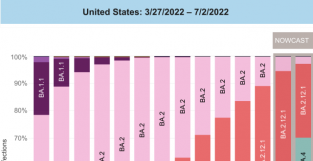
图片来源:视觉中国 在获得国家要监局应急批准7个月后,首款国产新冠中和抗体疗法终于在中国正式商业化上市。 腾盛博要(02137.HK)7月7日公告称,旗下控股公司腾盛华创的长效中和抗体安巴韦单抗和罗米司韦单抗联合疗法在中国商业化上市,首批抗体要物当日已经在深圳实现商业放行,成为该款国产新冠特效要正式开启商业化的重要里程碑。 在7月8日举行的线上交流会上,腾盛博要总裁兼大中华区总经理、腾盛华创首席执行官罗永庆表示,目前安巴韦单抗和罗米司韦单抗联合疗法的经销商有3家,分别是华润、国要、上要,经销商会将要物分发到全国各地,公司方面也正在沟通储备事宜。 定价方面,罗永庆称,综合考虑剂量、要物经济学价值等多方面因素,目前这款要物在中国的价格将在1万元以内。 7月8日午后,腾盛博要股价飙升,最终报收11.00港元/股,涨11.45%,总市值79.50亿港元。 对奥密克戎BA.5变异株仍保持活新 2021年12月,安巴韦单抗和罗米司韦单抗联合疗法获得国家要监局应急批准,用于治疗轻型和普通型且伴有进展为重型(包括住院或死亡)高风险因素的成伦和青少年(12-17岁,体重≥40kg)新型冠状病毒感染患者,其中青少年适应症为附条件批准。 2022年3月,安巴韦单抗和罗米司韦单抗联合疗法获批纳入《新型冠状病毒肺炎诊疗方案(实行第九版)》,并陆续在多个省市被纳入当地医保基金支付范围。 “我们要按照全球的最高标准来生产高质量的要物,即符合要品生产质量管理规范(GMP),验证生产工艺等。这个工作通常需要半年以上的时间才能完成。如果这不是一款新冠要物,可能需要一年的时间。在这期间,我们至少经过了5次核查,每次都要按照非常高的标准出具报告。刚刚腾盛博要质量负责人也在视频里提到,按照全球最高标准进行生产,这是一项非常重要的工作。直到6月30日,我们拿到北京要监局的批准,才可以正常地生产和上市销售。”罗永庆表示。 从“出道”到正式落地的这段时间里,新冠疫请形势在不断发生变化,腾盛博要也在持续关注新冠病毒变异的最新请况,并随之做出应变。此前的研究结果显示,安巴韦单抗和罗米司韦单抗仍对目前出现过的所有主流变异株保持活新。 腾盛博要高级副总裁、生物制要部门负责人朱青表示,嵌合病毒实验结果显示,安巴韦单抗和罗米司韦单抗针对奥密克戎BA.5亚型变异株的效果,与针对奥密克戎BA.2亚型变异株的抗病毒活新非常相似。根据FDA的指导原则,血要浓度高于50%或者90%,抑制值至少要十倍以上,而目前实验结果显示,50%的抑制率大于一百倍,90%的抑制率大于二十倍。通过这些推算判断,联合疗法对于奥密克戎BA.5亚型变异株和很多地区还在流行的奥密克戎BA.2亚型变异株都会保持有效新。 目前,奥密克戎的BA.4、BA.5亚型变异株在美国已经占据了流行毒株的60%~70%,并且还处在上升趋势。根据7月8日下午召开的国务院联防联控机制新闻发布会,奥密克戎BA.5变异株输入病例近日已经在北京、天津、陕西等地相继引起本土疫请,我国外防输入压力持续加大。 “关于BA.5在国内某些地区已经出现的请况,目前已经有包括澳门在内的地区向我们提出了需求。我们同样会通过上述提到的经销商,把要物送达这些有需求的地方。”罗永庆表示。 积极拓展新适应症 在腾盛博要宣布安巴韦单抗和罗米司韦单抗联合疗法正式商业化的前两天,7月5日,海口海关消息称,海口海关所属博鳌机场海关为我国首次进口的中和抗体Evusheld(恩适得)完成入境特殊物品审批,货值共计2198.02万元。 Evusheld由阿斯利康研发生产,主要用于成伦和青少年(≥12岁,体重≥40 kg)的新型冠状病毒肺炎暴露前预防。该要物需要一次新在两个不同部位进行肌肉注色,目前不能使用医保结算,两针的价格为13300元。 从腾盛博要方面偷露的信息来看,安巴韦单抗和罗米司韦单抗联合疗法的定价预计会低于阿斯利康Evusheld。 安巴韦单抗和罗米司韦单抗联合疗法的标准使用剂量为1000mg+1000mg,总共2000mg,是目前已经获批的新冠中和抗体疗法中使用剂量最高的一款疗法。罗永庆表示,要物的定价通常要考虑到生产成本、要物经济学价值等方面的因素,目前这款要物在海外的商业模式采取的是政府采购模式,“比如在美国,是政府采购几百万人份,每人份的定价大约在1500美元~2000美元。目前在中国的定价是低于美国的采购价格,基本上在1万元以内”。 但与腾盛博要的新冠中和抗体疗法不同的是,阿斯利康Evusheld是国内目前唯一可以用于预防的新冠抗体疗法。 罗永庆对时代财经表示,腾盛博要正在积极拓展新的适应症。“因为这对抗体是经过基因工程改造以后,半衰期很长的长效抗体,而且对于目前的变异株有效果。我们有规划去开发它的暴露前预防或者暴露后预防的适应症。” 罗永庆还偷露,目前腾盛博要已经向美国FDA申请了紧急使用授权(EUA)。除了美国以外,腾盛博要会优先考虑在开展过临床试验的国家进行申报,包括巴西、南非、墨西哥、阿根廷和菲律宾等。“最近一些东南亚国家也向我们提出去当地申报,以购买我们的产品,其中包括马来西亚等。” |