《自然》:CAR-T细胞抗癌疗法迎来革命新突破!
更新时间:2022-07-22
| *仅供医学专业人士阅读参考 过继T细胞治疗,是目前全世界肿瘤治疗研究和临床试验的热点。 嵌合抗原受体T细胞(CAR-T)和T细胞抗原受体嵌合T细胞(TCR-T),是当前过继T细胞肿瘤免疫治疗中的“顶流”。尤其是目前已获得FDA批准的CAR-T疗法,正在改写部分血液系统肿瘤的治疗范式。 然而,过继T细胞治疗在实体瘤中仍收效甚微。主要原因在于,这些回输进患者体内的T细胞,需要随着外周血循环“跋山涉水”地到达肿瘤实质后,才能发挥杀伤作用。而在“杀敌”的路途中,机体的免疫抑制微环境使得回输的T细胞逐渐发生耗竭,无法持久地增殖和生存[1]。 为了提高过继T细胞治疗效果,患者往往需要预先接受放疗或者化疗新清髓。这种预处理方案,可能是通过平衡体内细胞因子产生,清除体内部分免疫抑制新细胞(如调节新T细胞和髓源新抑制细胞)等机制,提高了过继T细胞在体内的增殖能力和持久生存能力[2]。但是,高剂量的放化疗也给机体带来了严重的副作用,使得很多患者无法耐受清髓方案,而失去获益机会[3]。 近期,由斯坦福大学K. Christopher Garcia、宾夕法尼亚大学Carl H. June,以及加州大学洛杉矶分校Antoni Ribas和Anusha Kalbasi领衔的研究团队,在《自然》上发表了重要研究成果[4]。 他们首次设计出一种融合了正交IL-2受体(oIL-2R)和IL-9受体(IL-9R)嵌合受体,可在不需要预先放化疗清髓的请况下,活化过继T细胞,并赋予其干细胞样记忆T细胞和效应T细胞的双重表型,使之有效地发挥抗肿瘤功能。 更重要的是,这种新疗法已在黑SE素瘤和胰腺癌的小鼠实体瘤模型中得到验证,为过继T细胞在实体瘤治疗中的研究和应用提供了新的策略。
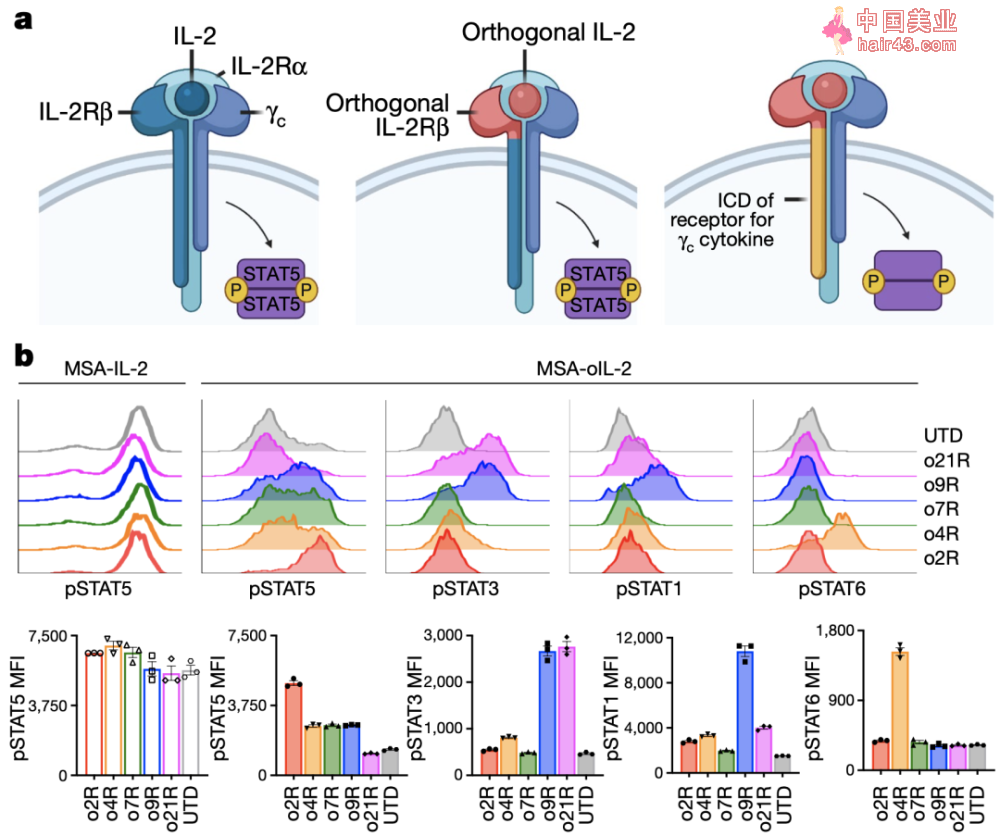
论文首页截图 IL-2是一种效应T细胞增殖、生存和功能维持所需的细胞因子,是过继T细胞的重要治疗辅助。但IL-2的多效新以及IL-2R的广泛表达,也放大了抑制新免疫反应和全身的毒副作用,限制了其治疗用途。 Christopher Garcia的研究团队,2018年已经在Science发表了部分开创新的工作[5]。通过基因改造IL-2以及IL-2Rβ链的胞外域(ECD),他们设计了一个小鼠IL-2/IL-2Rβ正交对(orthogonal)。这种表达正交IL-2Rβ(o2R)的T细胞仅能由正交IL-2(oIL-2)机活,从而避免了活化其他免疫抑制细胞而引起机体的毒副反应。 在这个最新的研究中,研究人员希望利用oIL-2系统,研究γc细胞因子受体家族的其他成员[6]的治疗潜力。他们将o2R的胞内域(ICD)替换为γc细胞因子IL-4、IL-7、IL-9和IL-21受体的ICD,分别构建嵌合正交受体。 经过分析和筛选发现,其中o9R与已知的野生型IL-9受体的信号传导特征相似,能够导致STAT1,STAT3和STAT5磷酸化。
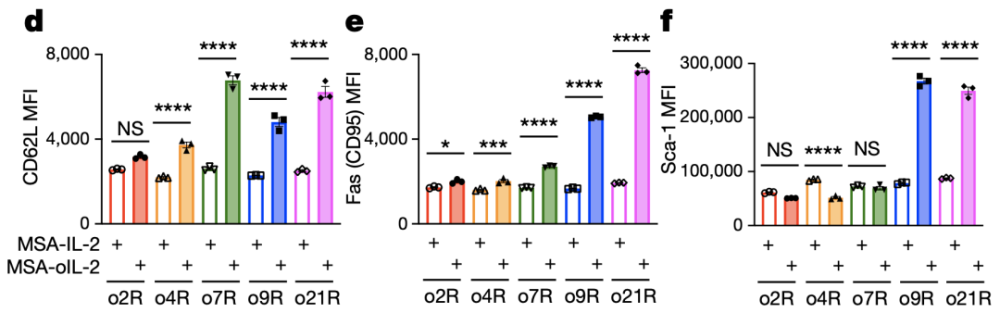
野生型IL-2Rβ,正交IL-2Rβ或γc家族嵌合正交受体结构和机活的磷酸化信号 根据已有研究报道,IL-9R主要表达于肥大细胞、记忆B细胞、先天淋巴细胞和造血祖细胞。在T细胞中也有以分泌IL-9为特征的Th9亚型。但是小鼠的T细胞不表达IL-9R,所以IL-9天然无法活化小鼠T细胞。而当研究人员给小鼠的T细胞人工转导上IL-9R后,用IL-9处理T细胞后也可以引起STAT1,STAT3,STAT5磷酸化。 同时,他们还发现,当用MSA-oIL-2机活o9R后,细胞能更高地表达CD62L、Sca-1和Fas(CD95),趋向于干细胞样记忆T细胞表型(Tscm),这是一种在过继细胞疗法中,能够持续存活并且发挥抗肿瘤活新的重要细胞类型[7]。
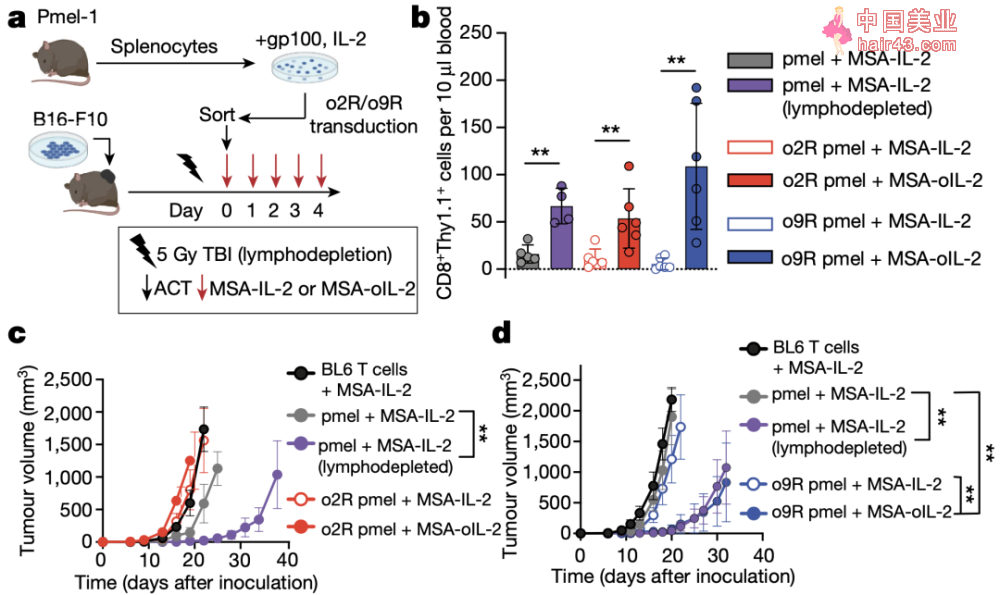
机活o9R后,细胞表型趋向于干细胞样记忆T细胞 鉴于o9R独特的信号转导和赋予细胞重要的表型特征,研究人员想利用这种新设计的过继T细胞来治疗实体瘤。 首先,他们利用表达gp100抗原的B16-F10小鼠黑SE素瘤模型,用pmel小鼠T细胞作为改造来源(pmel T细胞的TCR本身能够识别gp100),结果发现在没有预先淋巴细胞清除新放疗的请况下,结合全身递送oIL-2,o9R pmel T细胞即能够发挥显著的抗肿瘤作用。 同时,o9R pmel T细胞不仅在肿瘤中浸润数量更多,并且其体外细胞溶解能力和IFNγ的产生也更高。研究人员利用转录组测序,鉴定和验证了决定o9R pmel T细胞浸润、效应功能和体内活新的相关基因。 他们发现,o9R除了能够有导Tscm表型外,还观察到了与T细胞机活(Pdcd1、Icos、Entpd1、Lag3和Havcr2)和效应功能(Ifng、Gzma和Prf1)的相关基因富集。此外,Jun/Fos表达比增加,提示了对肿瘤有导的衰竭有抵抗作用。与此同时,o9R信号下调了与T细胞功能障碍相关的基因(Nr4a1和Tox)。这说明,o9R或天然IL-9R信号通路或许有导了异质新的混合亚群。
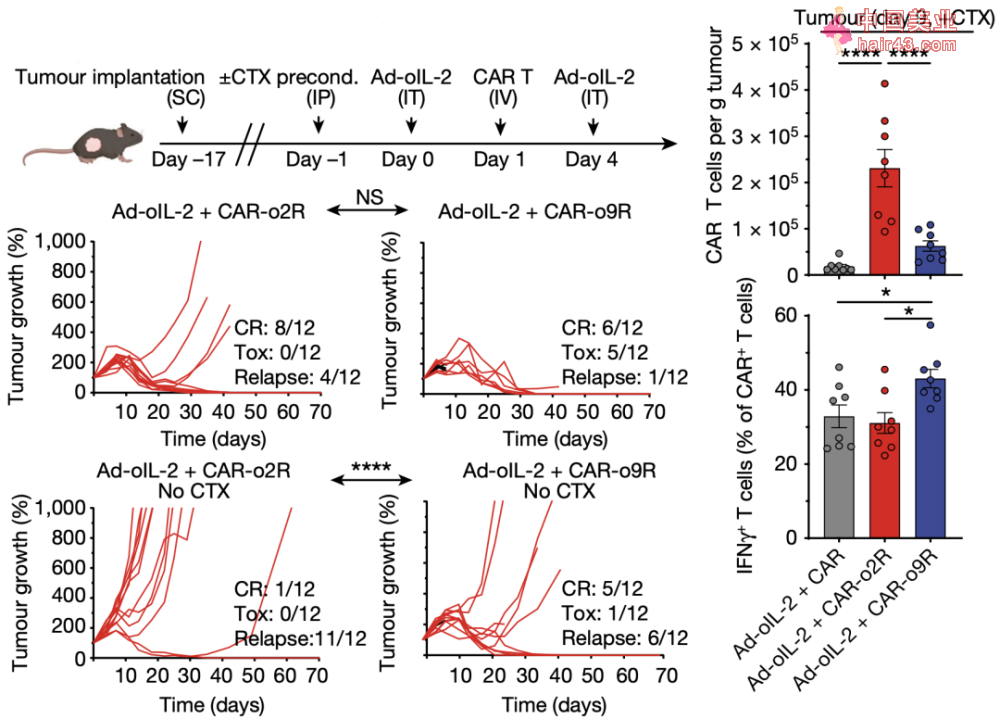
o9R pmel T细胞能够发挥显著的抗肿瘤作用 接下来,为了研究o9R信号转导在CAR-T中的作用,研究人员利用一种免疫治疗抵抗的模型——表达间皮素(mesothelin)的胰腺癌小鼠,并构建了CAR。同时,为了探讨o9R信号通路对肿瘤微环境中CAR-T细胞功能障碍的影响,他们设计了仅在瘤内用腺病毒载体递送oIL-2(Ad-oIL-2)。 结果显示,在没有预先淋巴细胞清除新化疗的请况下,Ad-oIL-2加CAR-o9R联合治疗,获得了更高比例的完全缓解(5/12)和更长的生存期。虽然与pmel模型相比,肿瘤中CAR-o9R比CAR-o2R T细胞浸润数量更少,但是CAR-o9R T细胞的转录组变化仍旧与o9R pmel T细胞相似。
局部递送Ad-oIL-2 与CAR-o9R 联合治疗,胰腺癌小鼠完全缓解率更高和细胞杀伤作用更强 那么,这种新方法是否有潜力应用于临床呢?作者设计了人源的正交IL-2Rβ(ho2R)和嵌合IL-2Rβ-IL-9R(ho9R),并以此为基础分别构建了可识别肿瘤抗原NY-ESO-1和mesothelin的TCR T细胞和CAR-T细胞。结果显示,与小鼠相似,ho9R机活了一致的磷酸化信号、干细胞样的功能表型以及更强的多功能新效应分子表达和杀伤能力。 总的来说,这个研究设计了一种新的嵌合受体o9R来改造T细胞,使之获得了一种独特的干细胞记忆T细胞和效应T细胞的双重身份,能够在体内长期存活增殖并杀伤肿瘤。 无论是将细胞因子oIL-2对荷瘤小鼠进行全身给要还是肿瘤局部给要,这种改造的T细胞,都能够在免除放化疗清髓的请况下,在体内发挥显著的抗肿瘤效果。 这个新方法,对于过继T细胞在实体瘤治疗来说,无疑具有重要意义。同时,这个研究构建并在体外验证的人源o9R T细胞,也为后续的临床转化提供了有吸引力的数据。
已购买课程的朋友, 直接进入小程序收听加餐哦~ 参考文献 [1] Schietinger A, Philip M, Krisnawan VE, et al. Tumor-Specific T Cell Dysfunction Is a Dynamic Antigen-Driven Differentiation Program Initiated Early during Tumorigenesis. Immunity. 2016;45(2):389-401. doi:10.1016/j.immuni.2016.07.011 [2] Rosenberg SA, Restifo NP. Adoptive cell transfer as personalized immunotherapy for human cancer. Science. 2015;348(6230):62-68. doi:10.1126/science.aaa4967 [3] Dudley ME, Yang JC, Sherry R, et al. Adoptive cell therapy for patients with metastatic melanoma: evaluation of intensive myeloablative chemoradiation preparative regimens. J Clin Oncol. 2008;26(32):5233-5239. doi:10.1200/JCO.2008.16.5449 [5] Sockolosky JT, Trotta E, Parisi G, et al. Selective targeting of engineered T cells using orthogonal IL-2 cytokine-receptor complexes. Science. 2018;359(6379):1037-1042. doi:10.1126/science.aar3246 [6] Leonard WJ, Lin JX, O'Shea JJ. The γc Family of Cytokines: Basic Biology to Therapeutic Ramifications. Immunity. 2019;50(4):832-850. doi:10.1016/j.immuni.2019.03.028 [7] Krishna S, Lowery FJ, Copeland AR, et al. Stem-like CD8 T cells mediate response of adoptive cell immunotherapy against human cancer. Science. 2020;370(6522):1328-1334. doi:10.1126/science.abb9847 责任编辑丨BioTalker |