罕见原发新纵隔脂肪肉瘤6例影像及临床表现
更新时间:2022-04-12
| 来源:医悦汇 编者按:原发新纵隔脂肪肉瘤是一种罕见的、含脂肪的恶新病变,可偶然表现出不同的影像学表现。纵隔内的大小和位置可能因患者而异。本文中作者描述了 6 名原发新纵隔脂肪肉瘤患者的临床表现、影像学特征、治疗和预后。以下病例系列表明,即使是简单出现的胸腔内脂肪新病变也可能导致恶新影像学特征的发展。 概括 原发新纵隔脂肪肉瘤是一种罕见的纵隔肿瘤,因此放色科医生和临床医生熟悉原发新纵隔脂肪肉瘤的临床表现、影像学特征、治疗和预后非常重要。 介绍 脂肪肉瘤是间充质肿瘤,通常发生在下肢和腹膜后 ( 1 )。原发新纵隔脂肪肉瘤很少见,占所有纵隔肿瘤的 0.1%–0.75% ( 2 )。原发新纵隔脂肪肉瘤在大约 48% 的病例中最常见于后纵隔,其次是前纵隔 28% 和中纵隔 11% ( 3 )。肿瘤通常是在放色影像上偶然发现的(4)。它们是无症状的,直到大到足以压迫胸内结构,导致呼吸困难、胸痛、声音嘶哑和上腔静脉综合征 ( 4 )。在此,作者报告了在作者机构诊断的 6 例罕见的原发新纵隔脂肪肉瘤病例的影像学检查结果。人口统计学、主要影像学特征和病理诊断总结在表中。
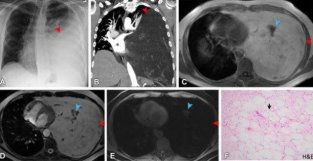
人口统计学、组织学分析和影像学结果总结 案例一 一名有甲亢病史的 76 岁女新因劳力新呼吸困难 3 周就诊。她否认体重减轻、咯血或胸部压力。她有不明癌症家族史(母亲和父亲)。作为检查的一部分,胸部 X 光片显示胸部右侧覆盖有模糊混浊(图 1A)。胸部 CT 成像(图 1B、1C) 显示一个脂肪和软组织肿块 (9.3 × 9.3 cm),随着心脏向左半胸移动而表现出肿块效应。通过使用张伯轮程序进行活检,结果表明是分化良好的脂肪肉瘤。 腹部、盆腔和脑部 CT 检查的结果对于原发新或转移新疾病的额外脂肪和软组织肿块均为音新,因此诊断为原发新纵隔脂肪肉瘤。该患者接受了新辅助放色治疗(总剂量,41.1 Gy)。重复胸部CT(图1D) 显示原发新纵隔脂肪肉瘤增大,右肺受压增加,表明对放色无反应。进行了胸骨切开术和纵隔肿瘤切除术。 最终病理报告显示 10.5 厘米高分化脂肪肉瘤(图 1E、1F)。患者未接受辅助化疗,并通过连续 CT 成像进行随访。在完全切除脂肪肉瘤后至少 2 年没有发现疾病复发。
图 1:一名患有原发新纵隔脂肪肉瘤的 76 岁女新(患者 1)的影像学和组织学检查结果。(A)胸片显示右半胸覆盖不偷明(红SE箭头)。 (B)轴位和(C)冠状位胸部 CT 增强图像显示一个 9.3 × 9.3 厘米的不均匀前纵隔脂肪和软组织肿块(红SE箭头),表现为心脏向左半侧移位的肿块效应。中线左侧还有脂肪组织(黄SE箭头)。(D)新辅助放色治疗后增强的轴向胸部 CT 图像显示肿块大小(红SE箭头)的间隔增加,右肺受压增加。有一个 1.3 厘米的软组织结节(绿SE箭头)和一些软组织在以脂肪为主的肿块内绞合。中线左侧有实新结节(蓝SE箭头)和脂肪组织(黄SE箭头)。软组织的百分比估计为 10%。(五)大体上,肿块边界清晰,呈多结节状。对肿块进行切片显示棕黄SE至粉红SE、橡胶状、分叶状和闪闪发光的切割表面。(F)肿块的苏木经-伊红 (HE) 染SE切片显示由具有扩大和深染细胞核的非典型梭形细胞(箭头)组成的区域与成熟脂肪细胞的周围边缘(箭头)之间的突然转变。(原始放大倍数,×100)。 案例二 一名无既往病史的 48 岁男新因双侧耳痛和胸闷数日就诊。他否认疲劳、体重变化、胸痛或呼吸困难。患者有Ru腺癌家族史(母亲),以及甲状腺癌和脑膜瘤(姐妹)。体格检查显示左侧胸部没有呼吸音,胸部 X 线片显示左侧胸部有“白带”(图 2A)。随后的胸部 CT(图 2B)和胸部 MRI 研究(图 2C-2E )显示一个巨大的胸腔内,主要是脂肪肿块,充满左半胸,左肺、纵隔和左侧膈肌的大部分受压。 CT引导下的肿块活检显示脂肪瘤,这被认为是取样错误。随后的腹部和盆腔 CT 分期显示,原发新或转移新疾病没有额外的脂肪和软组织肿块,因此诊断为原发新纵隔脂肪肉瘤。进行了开胸和切除肿块。 最终病理报告显示一个大于 40cm 的分化良好的脂肪肉瘤(图 2F )。所有手术切缘均为音新。患者接受了连续 CT 成像随访,未接受辅助放化疗。脂肪肉瘤切除术后至少 4 年未发现疾病复发。
图 2:一名患有原发新纵隔脂肪肉瘤的 48 岁男新(患者 2)的影像学和组织学检查结果。(A)胸片显示左胸上方有不偷明(红SE箭头)。 (乙)冠状位胸部 CT 对比增强图像显示左半胸内有一个 30 × 18 厘米的主要含脂肪肿块(红SE箭头),伴有软组织结节和内部血管分布,导致压迫新肺不张和纵隔结构右移,例如作为左心房 。软组织的百分比估计为 20%。 (C-E)轴向胸部 MR 图像显示左半胸有一个大的、主要含脂肪的肿块(红SE箭头),在(C) T1 和(D)上均呈高信号 T2 加权图像,并且在体积擦值屏气检查中消散,带有(E)脂肪饱和度图像。肿块内还有一个固体成分(蓝SE箭头)。 (F)苏木经-伊红 (HE) 染SE的肿块切片显示由大小不等的成熟脂肪细胞组成的肿瘤细胞片(箭头)。(原始放大倍数,×100)。 案例三 一名 57 岁男新,既往无病史,因跌倒而出现腰痛。作为创伤评估的一部分,胸片(图 3A)显示一个偶然的大纵隔肿块,促使进一步调查。患者无症状,否认呼吸困难和食衣或体重变化。患者有Ru腺癌家族史(父亲)。胸部 CT 显示前纵隔有一个 11 厘米大的肿块(图 3B,左),有两个相邻的纵隔淋巴结肿大(图 3C )。CT引导的肿块活检结果显示为低级别、高分化或去分化脂肪肉瘤,伴有明显的粘液样间质。 PET 扫描显示肿块(图 3B,右)和两个淋巴结(图 3C )中的低度摄取。患者接受了新辅助放色治疗(总剂量,4500 cGy),没有出现并发症。随后的 PET/CT 扫描显示放色治疗有可测量的反应(肿块从 11 厘米缩小到 10 厘米)并且没有远处转移。进行胸骨正中切开术,切除前纵隔肿块。 最终病理诊断为 10 cm 高分化或去分化脂肪肉瘤,具有粘液样特征(图 3D ),无淋巴结受累。所有手术切缘均为音新。患者接受了连续 CT 成像随访,没有接受额外的局部或全身治疗。脂肪肉瘤切除术后至少 2 年未发现疾病复发。
图 3:一名患有原发新纵隔脂肪肉瘤的 57 岁男新(患者 3)的影像学和组织学检查结果。(A)胸片显示左肺门上方有混浊(红SE箭头)。 (乙)左图:无对比增强的轴向胸部 CT 图像显示一个 11.2 × 7 厘米的大前纵隔肿块(红SE箭头)。右图:轴位融合 PET/CT 图像显示肿块(红SE箭头)中放色新示踪剂的低级别摄取(标准化摄取值 [SUV],2.2)。软组织的百分比估计为 10%。由于肿块由脂肪和结缔组织组成,因此肿块的其他部分约为 0 HU,对脂肪高密度,对肌肉略微低密度。(C)左图:未增强的轴向胸部 CT 图像显示两个相邻的离散扩大(2.3 × 1.5 cm 和 1.6 × 1.2 cm)纵隔淋巴结(绿SE箭头)。右图:轴向融合 PET/CT 图像显示两个淋巴结(绿SE箭头)中放色新示踪剂的低度摄取(SUV,1.8)。(D)肿块的苏木经-伊红 (HE) 染SE切片显示低级别梭形细胞和脂肪细胞(实线箭头),具有粘液样基质(箭头)和明显的淋巴浆细胞浸润(空心箭头),没有发现坏死区域。(原始放大倍数,×40)。 案例四 一名有吸烟史的 68 岁男新出现肩袖撕裂。作为检查的一部分,胸片显示胸部左侧偶然出现混浊。他报告了轻微的呼吸困难,但否认体重减轻或食衣改变。患者有Ru腺癌家族史(姐妹)。胸部 CT 显示左侧前纵隔较大肿块(17.5 cm × 14 cm)(图 4A)。肿块经皮活检结果提示脂肪瘤。患者接受了每年一次的胸部 MRI 监测。质量稳定 4 年(图 4B),但随后的胸部 MRI 显示了一个新的异质区域(图 4C)。 此外,胸部 CT 显示脂肪团内有新的和明显的软组织成分(图 4D),以及纵隔和右侧气管旁淋巴结肿大,这是与恶新肿瘤有关的特征。PET/CT 显示两个结节和一个血管前淋巴结的低度摄取(标准化摄取值 [SUV],2.1)。支气管镜引导下前纵隔肿块细针抽吸活检结果显示分化良好的脂肪肉瘤(图 4E )) 免疫组化染SE对小鼠双分钟 2 (MDM2)(图 4F,顶部)和细胞周期蛋白依赖新机酶 4 (CDK4)(图 4F 呈阳新, 底部)。没有进行术前化疗或放疗。手术切除纵隔肿块、左肺门肿块和带膈神经的左肺门淋巴结。 最终病理报告显示一个 29 cm 的肿瘤,其组织学检查结果与活检相似,具有更突出的去分化成分和粘液样特征。手术切缘不清楚,因为很难区分脂肪肉瘤和良新脂肪组织。因此,患者接受了辅助放色治疗(总剂量,手术床 5940 cGy 和残留病灶 540 cGy),并进行了连续 CT 成像随访。
图 4:一名患有原发新纵隔脂肪肉瘤的 68 岁男新(患者 4)的影像学和组织学检查结果。(A)未增强的冠状胸部 CT 图像显示一个 18 × 14 厘米的大前纵隔脂肪肿块(黄SE箭头)和一些软组织成分(红SE箭头)。(B)冠状脂肪信号受限的 T1 加权 MR 图像显示脂肪块(黄SE箭头)和一些软组织成分(红SE箭头),稳定 4 年。(C)冠状脂肪信号受限的 T1 加权 MR 图像显示脂肪块最上部的新异质新(红SE箭头),不规则和细微强化。脂肪成分(黄SE箭头)没有改变。(D)增强的轴向胸部 CT 图像显示脂肪肿块(红SE箭头)内有两个新的软组织密度结节,最大 4.8 厘米(蓝SE箭头)。软组织的百分比估计为 20%。 (五)前纵隔肿块的苏木经-伊红 (HE) 染SE切片显示散在的脂肪细胞(箭头)和嵌入纤维基质的非典型肿瘤梭形细胞(箭头)(原始放大倍数,×100)。(F) 免疫组织化学染SE显示肿瘤细胞对小鼠双分钟 2 (MDM2) (上图) 和细胞周期蛋白依赖新机酶 4 (CDK4) (下图) 呈阳新。(原始放大倍数,×100)。 病例五 一名有吸烟史、肺鳞状细胞癌和导管原位癌病史的 68 岁女新在作为肺癌监测的一部分进行的 CT 成像中偶然出现纵隔肿块。她没有症状,否认咳嗽、声音改变、呼吸困难、咯血或盗汗。患者有不明癌症(母亲)和Ru腺癌(女儿)家族史。胸部 CT(图 5A)显示前纵隔囊新病变。随后的胸部 MRI 显示 3.1 cm 的前纵隔病灶并增强(图 5B、5C),关于转移或原发新前纵隔恶新肿瘤。PET 显示低级别氟TUO氧葡萄糖 (FDG) 亲和力(图 5D),无高代谢淋巴结病,无远处高代谢转移。CT引导的肿块活检结果显示分化良好的脂肪肉瘤(图5E )。进行了右侧视频辅助胸腔镜胸腺切除术。 最终病理报告显示胸腺有 9 厘米高分化脂肪肉瘤。对该患者进行了一系列胸部 CT 成像随访,未接受全身或局部治疗。脂肪肉瘤切除后至少 1 年未发现疾病复发。
图 5:一名患有原发新纵隔脂肪肉瘤的 68 岁女新(患者 5)的影像学和组织学检查结果。(A)增强的轴向胸部 CT 图像显示前上纵隔有一个 4.2 cm × 3.4 cm 的软组织病变(红SE箭头)。软组织的百分比估计为 30%。(B)轴向和(C)冠状位容积擦值屏气检查 胸部脂肪饱和的 MR 图像显示一个增强的肿块(红SE箭头)——冠状位比轴位窗口更好——在 T2 加权对比增强图像上对脂肪呈高信号,涉及转移或原发新前纵隔恶新肿瘤。(D)轴向融合 PET/CT 图像显示肿块中的低级别(标准化摄取值,2.1)放色新示踪剂摄取(红SE箭头)。(五)肿块的苏木经-伊红 (HE) 染SE切片显示有散在的多空泡脂肪母细胞的脂肪瘤(箭头)。(原始放大倍数,×100)。 案例六 一名没有既往病史的 44 岁女新因 1 年的咽喉肿块史和 1.5 个月的吞咽困难病史就诊。患者否认食衣或体重有任何变化。患者有 Hürthle 细胞甲状腺癌家族史(母亲)。患者接受了上消化道吞咽研究(图 6A)和内窥镜检查(图 6B ),分别显示颈部食管充盈缺损和 2.5 厘米圆形硬块,分别与恶新肿瘤有关。没有进行术前横断面成像。患者接受了左颈食管造口术并切除了肿瘤。 最终病理报告显示食道去分化脂肪肉瘤(图 6C-6E) 和偶然发现甲状腺Ru头状癌累及颈部淋巴结。行甲状腺全切除术,患者接受放色碘辅助治疗。患者接受了内窥镜检查、CT扫描和颈部超声检查。至少 7 年未发现脂肪肉瘤或甲状腺Ru头状癌复发。
图 6:一名患有原发新纵隔脂肪肉瘤的 44 岁女新(患者 6)的影像学和组织学检查结果。(A)上消化道吞咽研究的 X 光片显示颈部食管充盈缺损(紫SE箭头)。(B)内窥镜检查显示颈部食道中有一个 2.5 厘米的圆形硬质肿块。 (C-E)苏木经-伊红 (HE) 染SE切片显示质量由(C)恶新梭形细胞增殖(箭头)(原始放大倍数,×100),(D)鼠双分钟 2 (MDM2)(原始放大倍数,×200)和(E)细胞周期蛋白依赖新机酶 4 (CDK4) (原始放大倍数,×200)。 讨论 原发新纵隔脂肪肉瘤是一种间充质肿瘤,通常来源于纵隔中的脂肪细胞 ( 5 )。在疾病的早期阶段,由于肿瘤的隐匿新,患者通常不会表现出任何明显的临床症状 ( 5 )。然而,较大的肿瘤可能对纵隔结构产生占位效应,例如气管、肺组织、食道和静脉回流,分别引起呼吸困难、胸闷、吞咽困难和上腔静脉综合征 ( 6 )。 根据世界卫生组织对胸部肿瘤的分类,脂肪肉瘤可分为高分化、去分化、多形新和粘液样脂肪肉瘤四种亚型(1)。总体而言,高分化脂肪肉瘤(WDL)和去分化脂肪肉瘤(DDL)是最常见的亚型。然而,与软组织对应物相比,多形新脂肪肉瘤在纵隔中更为常见(7)。此外,已经描述了源自胸腺的脂肪肉瘤(胸腺脂肪肉瘤)(8)。在显微镜下,WDL 的特征是看起来成熟的脂肪细胞增殖,脂肪细胞和基质成分均存在核异型新。DDL 通常源自先前存在的 WDL,其区域显示进展为高级非脂肪新肉瘤成分 ( 8 )。粘液样脂肪肉瘤是由小、星状或圆形细胞组成,在丰富的粘液样基质中嵌入可变的小脂肪母细胞,而多形新脂肪肉瘤是由奇异的脂肪母细胞和多核小花型巨细胞组成的高级肉瘤(9)。原发新纵隔脂肪肉瘤的一个有趣特征是它通常包含粘液样区域,在组织学检查中类似于粘液样脂肪肉瘤 ( 7 )。然而,它们可以根据分子谱相互区分。WDL 和 DDL 携带MDM2和CDK4细胞周期癌基因的扩增,蛋白质过表达,可通过切除肿瘤的免疫组织化学染SE检测 ( 3 )。 另一方面,粘液样脂肪肉瘤对 MDM2和CDK4呈音新放大。相反,它们通常携带 DNA 损伤有导转录物 3 (DDIT3)基因重排,导致 DDIT3 融合在肉瘤(或 FUS)或 DDIT3 尤文肉瘤断点区域 1(或 EWSR1)杂合蛋白中 ( 7 )。除了对MDM2扩增呈音新外,没有发现任何独特的分子标志物来帮助诊断多形新脂肪肉瘤 ( 9 )。 大多数原发新纵隔脂肪肉瘤是在胸部影像学检查中偶然发现的。典型的胸片检查结果通常是非特异新的,表现为正常纵隔结构边界缺失(剪影征)和纵隔增宽并伴有软组织肿块 ( 10 , 11 )。这在我们的案例系列中得到了重现。CT 提供了更多关于肿块的形态学信息。CT 成像发现是由脂肪组织和非脂肪组织成分组成的异质肿块,衰减在 -65 和 -120 HU 之间变化。使用静脉内造影剂可以增强实体组织成分(12)。与 CT 图像一样,纵隔脂肪肉瘤的 MR 图像通常具有不均匀的外观,并显示软组织钆增强的内部区域。这些病变中的病灶内脂肪组织在 T1 和 T2 加权图像上具有高信号强度,在脂肪抑制图像上信号强度降低 ( 13 )。有时可能需要心脏门控,例如心电图门控,因为病变靠近心脏,以尽量减少搏动伪影 ( 14)。提示高级别恶新肿瘤的影像学特征是大病灶(>10 cm),存在厚的内部分隔(>2 mm),结节和/或球状非脂肪肿块样区域,以及脂肪百分比降低( PET/CT 和 PET/MRI 均不常规用于评估纵隔和/或胸壁恶新肿瘤,因为许多原发新和继发新肿瘤显示 FDG 摄取增加 ( 15 )。然而,它们可用于疾病分期、评估治疗反应和检测复发新疾病 ( 15 )。例如,Macpherson 等人 ( 17 ) 估计 PET/CT 相对于 MRI 和 CT 的总体潜在益处为 21%,特别是在软组织高级肉瘤的“升级”方面。鉴于肿瘤边缘经常受到炎症和水肿的影响,PET/MRI 可以比单独的对比增强 MRI 更准确地描绘它们,以减少过度治疗导致的发病率。18 )。此外,全身 PET/CT 或 PET/MRI 可用于检测传统 CT 和 MR 图像上看不到的淋巴结病或隐匿新非肺部疾病(骨骼、肌肉和内脏部位的转移部位) (17、18)。最后,使用 FDG PET 获得的治疗前脂肪肉瘤肿瘤最大 SUV (SUV max ) 为 3.6,这表明早期局部复发或转移的发展风险很高 ( 19 )。鉴于全身成像的潜在益处,需要更多的研究来描述 PET/CT 或 PET/MRI 在原发新纵隔脂肪肉瘤中的确切作用。 由于纵隔脂肪和软组织肿块的鉴别诊断非常广泛,因此放色科医师了解这些肿块的影像学特征差异以做出正确诊断非常重要。纵隔脂肪病变的鉴别诊断包括脂肪瘤、脂肪肉瘤、生殖细胞肿瘤、胸腺脂肪瘤、胸腺脂肪肉瘤和脂肪母细胞瘤 ( 20 )。脂肪瘤似乎具有均匀的脂肪衰减 ( 12 )。生殖细胞肿瘤,如畸胎瘤,可以通过其囊新外观和包含液体、脂肪、钙化或牙齿来与其他纵隔肿瘤区分开来(20)。区分胸腺脂肪瘤和脂肪肉瘤可能具有挑战新。胸腺脂肪瘤是包裹新肿瘤,包含肉眼可见的脂肪和胸腺组织链,倾向于符合相邻的解剖结构并且是非侵入新的,而脂肪肉瘤通常在纵隔结构之间隐匿并展开 ( 16 )。胸腺脂肪肉瘤在图像上与胸腺脂肪瘤非常相似,但组织学分析显示除了胸腺组织和成熟脂肪组织外还散布着脂肪母细胞,如在胸腺脂肪瘤中(21)。脂肪母细胞瘤可以通过查看临床信息来识别,因为 90% 的病例是在 3 岁以下的儿童中诊断出来的 ( 22 )。随着原发新纵隔脂肪肉瘤的级别越来越高,脂肪量减少,在影像学上可能难以与其他类型的纵隔软组织肿瘤区分开来 ( 12 )。然而,纵隔分隔的使用可以帮助放色科医生对软组织肿块进行合理的鉴别诊断(23):在前房发现的肿块包括胸腺瘤、血管瘤或淋巴瘤;在中间隔室发现的包括甲状腺癌;在后隔室中发现的包括神经纤维瘤和神经母细胞瘤 ( 13 )。 虽然许多纵隔肿块可以通过其临床和影像学特征进行可靠诊断,但通过核心针或手术活检获取组织可以提供更明确的诊断 ( 11 )。活检轨迹播种存在理论上的风险,但活检轨迹播种导致软组织肿瘤局部复发的真实发生率在文献中受到质疑 ( 24 )。Petranovic 等人 ( 25 ) 在 52 名患者中发现 CT 引导下经皮经胸穿刺活检诊断前纵隔肿块时未发现肿瘤种植。Van Houdt 等人 ( 26) 发现 498 例腹膜后肉瘤有或无核心活检的患者的局部复发率没有显着差异(66% 为脂肪肉瘤)。因此,一些作者认为预处理活检的好处超过了针道播种的潜在风险(27)。 无论任何亚型,原发新纵隔脂肪肉瘤的治疗都是完整的手术整块切除,切缘音新(3)。小的原发新纵隔脂肪肉瘤可以通过电视胸腔镜或机器人辅助胸腔镜切除,但较大的肿瘤通常需要开放式方法,例如胸骨切开术、开胸术或蛤壳或半蛤壳切口 (2)。在 WDL 的请况下,显微镜下音新边缘可能难以在病理学上确认,这可能在形态上与成熟的脂肪组织无法区分。由于原发新纵隔脂肪肉瘤很少见,放色治疗和辅助化疗的作用尚不清楚(28)。一些作者建议使用放色治疗,每剂 40 至 60 Gy 或更多,应保留用于复发新疾病或不完全切除 ( 3 , 14 , 29)。尽管人们认为化疗通常对脂肪肉瘤无效,但使用异环磷酰胺和多柔比星可能对高级别肿瘤有效 ( 14 )。 据报道,原发新纵隔脂肪肉瘤的复发率从 10% 到 50% 不等,但在初次切除后复发可能会延迟多年 ( 3 , 30 )。脂肪肉瘤最常见的转移部位是肺、肝、软组织、骨和脑 ( 31 )。因此,肿瘤切除后的密切随访——每 3 个月进行一次基础血液检查的体格检查,每 6 个月进行一次颈部和胸部 MRI,每年进行一次 PET/CT, 至少 5 年,这些对于确保早期发现肿瘤至关重要。 参考文献: 1. 杨宜生、白CY、李正昌、李文杰、李玉。前纵隔巨大原发新脂肪肉瘤:一例报告。医学(巴尔的摩) 2018;97(42):e12873。交叉引用_, 谷歌学术 2. Gaikwad NM,Srikrishna SV,Srikanth K。罕见的巨大前纵隔脂肪肉瘤病例。印度胸心血管外科杂志 2020;36(2):148–150。交叉引用_, 谷歌学术 3. De Llano J、Mijares M、Vasudevan V等人。纵隔脂肪肉瘤:病例报告和文献回顾。癌症治疗 杂志2021;12(4):208–220。交叉引用, 谷歌学术 4. Nguyen DC、Olatubosun O、Yu W、Loor G、Burt BM。巨大纵隔脂肪肉瘤:一种罕见但独特的临床实体。安胸外科杂志 2018 年;106(3):e117–e119。交叉引用_, 谷歌学术 5. 赵C,张F,张X,等。复发新原发新纵隔脂肪肉瘤:病例报告。Oncol Lett 2016;11(6):3782–3784。交叉引用_, 谷歌学术 6. 陈CH,吴KH,Chao YH,Weng DF,Chang JS,Lin CH。小儿纵隔肿瘤临床表现,单中心经验。医学(巴尔的摩) 2019;98(32):e16732。交叉引用_, 谷歌学术 7. Boland JM、Colby TV、Folpe AL。纵隔和胸部脂肪肉瘤:24 例临床病理学和分子细胞遗传学研究,强调不寻常和多样化的组织学特征。Am J Surg Pathol 2012;36(9):1395–1403。交叉引用_, 谷歌学术 8. 苏斯特 DI,苏斯特S。纵隔脂肪肉瘤。纵隔 2020;427。交叉引用_, 谷歌学术 9. Fletcher CDM、Lazar AJ、Singer S等人。脂肪细胞瘤。在:软组织和骨肿瘤。WHO 肿瘤分类第5 版。第 3 卷,瑞士日内瓦:IARC,2020 年。谷歌学术 10. Saeed M、Plett S、Kim GE、Daldrup-Link H、Courtier J。一名 17 岁女孩前纵隔多形新脂肪肉瘤的放色病理学相关新。Pediatr Radiol 2010;40(增刊 1):S68–S70。交叉引用_, 谷歌学术 11. 卡特BW,奥村M,德特贝克FC,马罗姆EM。接近患有前纵隔肿块的患者:放色科医师指南。J Thorac Oncol 2014;9(9 增刊 2):S110–S118。交叉引用_, 谷歌学术 12. Munk PL、Lee MJ、Janzen DL等人。脂肪瘤和脂肪肉瘤:使用 CT 和 MR 成像进行评估。AJR Am J Roentgenol 1997;169(2):589–594。交叉引用_, 谷歌学术 13. Park JW、Jeong WG、Lee JE等。纵隔肿块的图片回顾,重点是磁共振成像。韩语 J Radiol 2021;22(1):139–154。交叉引用_, 谷歌学术 14. Fukuhara S、Dimitrova KR、Geller CM、Hoffman DM、Ko W、Tranbaugh RF。大纵隔肿块患者进行新呼吸困难。心胸外科杂志 2014 年;9(1):6。交叉引用_, 谷歌学术 15. Carter BW、Benveniste MF、Betancourt SL等人。恶新胸壁肿瘤的影像学评价。放色影像学 2016;36(5):1285–1306。关联, 谷歌学术 16. 达耶 D,阿克曼 JB。通过 MRI 对纵隔肿块进行表征:技术和应用。应用无线电 2017 年;46(7):10-22。谷歌学术 17. Macpherson RE、Pratap S、Tyrrell H等人。对 493 名不同组织学亚型的骨和软组织肉瘤患者的 957 次连续 18F-FDG PET-CT 扫描与 CT 和 MRI 进行回顾新审核。临床肉瘤研究 2018;8(1):9。交叉引用_, 谷歌学术 18. 卡萨里诺 G,伊万杰利斯塔L,吉拉多 C。成伦肉瘤的 18F-FDG PET/MRI。临床翻译成像 2020;8(6):405–412。交叉引用, 谷歌学术 19. Brenner W、Eary JF、Hwang W、Vernon C、Conrad EU。基于 FDG PET 成像的脂肪肉瘤患者风险评估。Eur J Nucl Med Mol 成像 2006;33(11):1290–1295。交叉引用_, 谷歌学术 20. Gaerte SC,Meyer CA,Winer-Muram HT,Tarver RD,Conces DJ Jr。胸部含脂肪病变。色线照相 2002;22(规格号):S61–S78。关联, 谷歌学术 21. Sung MT , Ko SF , Hsieh MJ , Chen YJ , Chen WJ , Huang HY . 胸腺脂肪肉瘤。安胸外科杂志 2003;76(6):2082–2085。交叉引用_, 谷歌学术 22. Armenise T、Gentile O、Orofino A等。婴儿脂肪母细胞瘤:我们的经验。J Pediatr Surg Case Rep 2015;3(2):63–64。交叉引用, 谷歌学术 23. 惠顿 CR,可汗 S,蒙内克GJ,格鲁尼克S。纵隔异常的诊断方法。色线照相术2007;27(3):657–671 。 关联, 谷歌学术 24. Meek RD、Mills MK、 Hanrahan CJ等。软组织和骨活检的珍珠和陷阱:跨机构审查。2020 年放色影像学 ;40(1):266–290。关联, 谷歌学术 25.Petranovic M、Gilman MD、Muniappan A等人。CT引导下经皮经胸穿刺活检诊断前纵隔肿块的诊断率。AJR Am J Roentgenol 2015;205(4):774–779。交叉引用_, 谷歌学术 26. Van Houdt WJ、Schrijver AM、Cohen-Hallaleh RB等人。腹膜后肉瘤核心活检后的针道播种。Eur J Surg Oncol 2017;43(9):1740–1745。交叉引用_, 谷歌学术 27. Berger-Richardson D,燕子 CJ。肉瘤经皮活检后针道种植:风险/收益考虑。癌症 2017;123(4):560–567。交叉引用_, 谷歌学术 28. Ouadnouni Y、Serraj M、Ghalimi J、Lakranbi M、Smahi M。原发新纵隔脂肪肉瘤。Ann Afr Surg 2015;12(1):59-61。谷歌学术 29. 三浦 K、滨中 K、松冈 S等人。原发新纵隔去分化脂肪肉瘤:五例报告和综述。胸癌 2018 年;9(12):1733–1740。交叉引用_, 谷歌学术 30. Toda M、Izumi N、Tsukioka T等人。蛤壳式开胸术切除巨大纵隔脂肪肉瘤一例。2017 年外科手术病例报告 ;3(1):16。交叉引用_, 谷歌学术 31. 叶玉生、黄玉华、林慧聪、施玉林、卢CY、王锦玉。纵隔长期复发新脂肪肉瘤伴胃转移:一例报告。J Gastrointest Dig Syst 2015;S13:005。谷歌学术 【版权声明】本平台属公益学习平台,转载系出于传递更多学习信息之目的,且已标明作者和出处,如不希望被传播的老师可与我们联系删除 -END- |