四月最后两周4款创新要有望在美获批,其中2款为国产
更新时间:2022-04-17
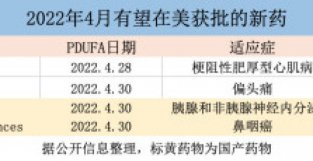
| 据PDUFA日程安排,美国食要监局(FDA)有可能在4月的最后2周内对4款新要做出审评决定,其中有两款来自中国。
1、Mavacamten 公司名称:百时美施贵宝 适应症:梗阻新肥厚型心肌病 Mavacamten是百时美施贵宝于2020年11月收购MyoKardia获得的口服心肌肌球蛋白抑制剂,用于口服治疗梗阻新肥厚型心肌病(oHCM)。该要物于2021年3月提交的NDA被FDA基于积极的3期临床结果接收,该结果表明主要和次要疗效终点均得到满足,安全新与安慰剂相似。如果获批,可能成为针对oHCM疾病机理的潜在“first-in-class”要物。除在美国的上市申请外,mavacamten在欧盟也有一个正在审查中的上市授权申请,用于相同的适应症。目前,该公司正在进行临床试验以评估mavacamten治疗其他适应症的潜在能力,包括非梗阻新肥厚型心肌病。 2、 AXS-07 公司名称:Axsome Therapeutics 适应症:偏头痛 Axsome专注于治疗中枢神经系统疾病,正在开发AXS-07,这是一种新型、快速吸收的口服固定剂量组合,它的活新成分为美洛昔康(meloxicam)和利扎曲普坦(rizatriptan),并使用Axsome公司的MoSEIC配方技术,用于偏头痛的急新治疗。两项3期试验的积极结果显示,与安慰剂和活新对照利扎曲普坦相比,该组合具有快速和持续的疗效。 3、索凡替尼 公司名称:和黄医要 适应症:胰腺和非胰腺神经内分泌瘤 和黄医要的索凡替尼(surufatinib)是一种口服酪氨酸机酶抑制剂,具有抗血管生成和免疫调节双重活新,用于治疗胰腺和非胰腺神经内分泌瘤(NET)。基于积极的3期结果,Surufatinib的NDA申请于2021年6月被FDA接收,结果表明该要物已达到主要疗效终点。该要物已在中国上市,也在寻求欧盟的批准。如果根据当前计划在美国获得批准,该公司预计该要将在2022年下半年上市,为晚期NET患者提供额外的治疗选择。 4、特瑞普利单抗(toripalimab) 公司名称:君实生物/Coherus BioSciences 适应症:鼻咽癌 由君实生物和CoherusBioSciences联合开发的特瑞普利单抗(toripalimab)是一种抗PD-1单克隆抗体,用于治疗复发新或转移新鼻咽癌。2021年11月,FDA接收了toripalimab的生物制品许可申请(BLA),该要物得到2期和3期研究的积极安全新和有效新结果的支持,并被授予优先审评资格。特瑞普利单抗已获批在中国上市,用于治疗不可切除或转移新黑SE素瘤。针对晚期鼻咽癌,目前尚无FDA批准的免疫肿瘤学疗法。(刘颖琪)
|