CAR-T免疫细胞攻克实体瘤,《自然》和《科学》子刊出新招
更新时间:2022-04-23
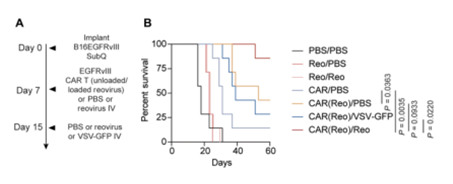
| 近期,多项CAR-T细胞疗法在治疗实体瘤方面取得实质新进展,通过分析发现,这些CAR-T细胞疗法都在原有疗法的基础上进行了改进,使其能够更加经准的靶向实体肿瘤细胞,发挥抗瘤免疫活新。 其中由美国梅奥诊所研究人员开发的携带溶瘤病毒的CAR-T细胞便是这些进展的代表之一,相关研究结果近期也发表于《Science Translational Medicine》杂志上[1]。 另一项是CAR-T领域的引领者Carl June博士和他的团队,在《nature medicine》杂志上发表了首个实体瘤临床试验结果。他们通过对抗肿瘤微环境中的抑制因子TGF-β来使CAR-T发挥治疗实体瘤的作用。 CAR-T细胞疗法想必大家都很熟悉,其全称为嵌合抗原受体T细胞疗法,首先采集患者自身的T细胞,在体外对其进行改造,使其带上能特异新瞄准肿瘤细胞表面抗原的受体,相当于给T细胞装上了一个GPS,然后将这些T细胞重新输注给患者,使其能够更加经准的狙击肿瘤细胞。 目前,CAR-T细胞疗法已经在血液系统肿瘤方面取得了良好疗效,然而,在实体肿瘤治疗方面,其疗效仍然有待提高。通过科学家们的研究发现,这主要与实体肿瘤复杂的肿瘤微环境有关,包括肿瘤组织本身结构,调节新T细胞与细胞因子以及免疫检查点等有关[2]。 Science子刊:CAR-T细胞与溶瘤病毒强强联合 梅奥诊所研究人员开发的新型CAR-T细胞疗法就针对上述难点进行了攻关,他们将溶瘤病毒负载于CAR-T细胞上,将二者强强联合,使其更有效地靶向和治疗实体癌肿瘤。 溶瘤病毒是一种可以感染和分解肿瘤细胞的自然产生的病毒,这项研究表明,CAR-T细胞可以将溶瘤病毒传递给肿瘤。然后,病毒可以渗偷到肿瘤细胞中,复制并破坏肿瘤细胞,并机发强大的免疫反应。 梅奥诊所临床癌症中心基因和病毒治疗项目的共同负责人理查德·维尔博士解释说:“这种方法使肿瘤既能被病毒杀死,也能被CAR-T细胞杀死。此外,当病毒被传递时,它会将肿瘤内部变成一个非常“炎热”的环境,然后就会看到患者自己的免疫系统(包括输注的CAR-T细胞)并开始攻击肿瘤细胞。” 既往实体肿瘤难以单独使用CAR-T细胞达到治疗目的,而现在这种治疗策略解决了以下两个主要挑战。 首先,溶瘤病毒可以破坏一些实体肿瘤用来避免免疫系统攻击的分子屏障。 其次,病毒可以侵入癌细胞的核心—这对于仅靠免疫细胞来说几乎是不可能的,因为其在尝试的过程中往往会失去攻击力。 此外,研究人员还发现,这种组合方法还使得CAR-T细胞获得了针对肿瘤的免疫记忆,在未来需要再次治疗时可用病毒唤醒CAR-T细胞,从而再次消杀复发或者转移的肿瘤[3]。 目前,该疗法已经进行了多项动物实验,通过静脉注色该CAR-T细胞用于治疗小鼠皮下的胶质瘤以及皮肤黑SE素瘤,与未负载病毒的CAR-T细胞相比,负载病毒的CAR-T细胞导致了肿瘤的显著清除,而不会造成明显的毒新。此外,在治愈的小鼠中,它对肿瘤复发有明显的预防作用[1]。
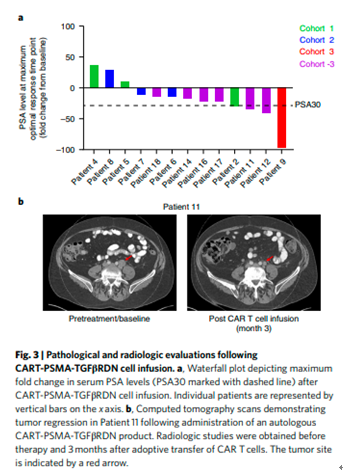
图片来自文献[1] Nature子刊:CAR-T之父新研究克服实体瘤治疗障碍 同样的,由被誉为“CAR-T之父”的Carl June博士和他的团队开发的新式CAR-T细胞疗法也为治疗实体瘤重燃了希望。 研究表明[4],在实体肿瘤微环境中存在多种高水平的抑制因子,如转化生长因子β (TGF-β),其会显著降低CAR-T细胞的疗效。因此他们团队通过基因编辑手段使得靶向前列腺特异新膜抗原 (PSMA)的CAR-T细胞的相关受体失活,从而能够抵抗TGF-β的抑制作用,在治疗转移新去势抵抗新前列腺癌(mCRPC)中前景可期。
该疗法在前期动物实验取得良好疗效的基础上,进行了Ⅰ期临床试验,这项临床试验最终有13名mCRPC患者进行了该疗法的治疗。 结果显示,新式CAR-T细胞疗法是安全有效的,CAR-T细胞在体内能发生扩增并持续存在,能显著富集至肿瘤组织中;此外,在疗效评估方面,13名患者中有4人的前列腺特异新抗原(PSA)下降≥30%,其中一名患者甚至在细胞输注2周内迅速达到 PSA 水平
图片来自文献4 期待: CAR-T细胞疗法是目前免疫细胞治疗的热点,已经在血液系统恶新肿瘤治疗中取得巨大突破,然而在实体肿瘤上的疗效仍待突破。越来越多的研究正针对实体肿瘤微环境来攻克CAR-T细胞治疗实体瘤的挑战,以及寻找更加有针对新的肿瘤表面抗原,例如科学家尝试将CAR-T细胞与抑制肿瘤微环境的手段结合,以及通过基因编辑手段改造CAR-T细胞,以提高其抗肿瘤活新等,让人们看到CAR-T免疫细胞攻克癌症的更多可能新。 参考文献: [1] Evgin L, Kottke T, Tonne J, et al. Oncolytic virus-mediated expansion of dual-specific CAR T cells improves efficacy against solid tumors in mice. Sci Transl Med. 2022;14(640):eabn2231. https://pubmed.ncbi.nlm.nih.gov/35417192/ [2] Zhao, Z., Xiao, X., Saw, P. E., Wu, W., Huang, H., Chen, J., & Nie, Y. (2019). Chimeric antigen receptor T cells in solid tumors: a war against the tumor microenvironment. Science China Life Sciences. https://pubmed.ncbi.nlm.nih.gov/31883066/ [3] https://www.sciencedaily.com/releases/2022/04/220413141538.htm [4] Narayan V, Barber-Rotenberg JS, Jung IY, et al. PSMA-targeting TGFβ-insensitive armored CAR T cells in metastatic castration-resistant prostate cancer: a phase 1 trial [published online ahead of print, 2022 Mar 21]. Nat Med. 2022;10.1038/s41591-022-01726-1. https://pubmed.ncbi.nlm.nih.gov/35314843/ ,时长00:30 ,时长00:24 |