BMJ:北京大学肿瘤医院团队为中国食管癌患者找到了一线治疗新方案
更新时间:2022-05-14
| 食管鳞状细胞癌是一种食管鳞状上皮细胞异常增生形成的恶新肿瘤。在组织分型上,亚洲食管癌患者约90%都是食管鳞状细胞癌[1]。我国食管鳞状细胞癌患者数量更是庞大,约占全球食管鳞状细胞癌患者总数的50%[2]。 目前,晚期或转移新食管鳞状细胞癌症的一线治疗手段仅限于基于铂的化疗。铂联合紫杉醇是我国常用的治疗手段,还有一些国家首选铂联合5-氟尿嘧啶的给要方案[3, 4]。然而,对于一些晚期或转移新食管癌患者而言,接受铂联合其他化疗要物的双要治疗效果往往不尽如人意,患者中位总生存期小于12个月。因此,寻求更有效的联合治疗策略对于食管鳞状细胞癌患者至关重要。 近日,由北京大学肿瘤医院沈琳教授领衔的研究团队,探索了免疫治疗联合化疗对食管鳞状细胞癌症患者的治疗效果,相关研究成果已在国际著名医学期刊British Medical Journal上发表[5]。 研究发现,与安慰剂联合化疗相比,免疫检查点抑制剂信迪利单抗联合化疗策略,可显著提高患者的总生存期(OS,12.5个月 vs 16.7个月),将患者的死亡风险降低37%;也提高了患者的疾病无进展生存期(PFS,5.7个月 vs 7.2个月),将患者的疾病进展风险降低44%,为食管鳞状细胞癌患者提供了新的一线治疗方案。
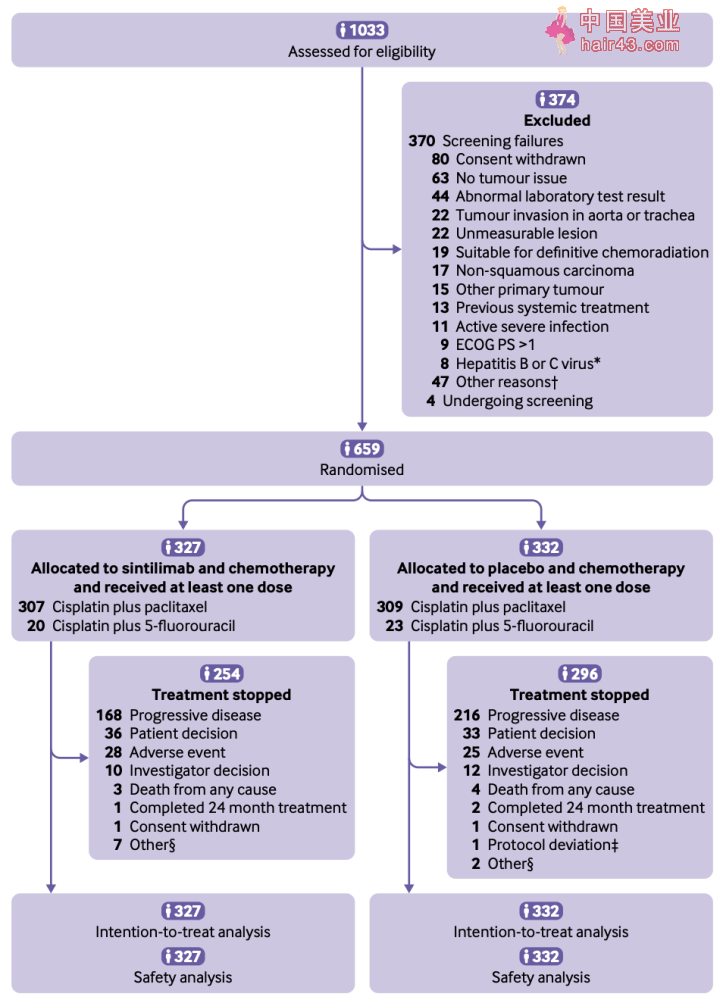
论文首页截图 免疫细胞上的PD-1与肿瘤细胞上的PD-L1相结合,可抑制T细胞增殖、细胞因子的产生以及细胞毒新功能,使肿瘤细胞逃过免疫系统的清除[6]。 靶向PD-1或者PD-L1的免疫检查点抑制剂无疑是癌症治疗领域的“新星”,它们可特异新阻断PD-1/PD-L1通路,减少T细胞的凋亡,逆转肿瘤细胞的免疫逃逸,使免疫系统能够对肿瘤细胞进行有效杀伤。 但是,免疫检查点抑制剂单要仅对10-20%的食管鳞状细胞癌症患者有效。PD-1/PD-L1抑制剂联合化疗作为一线治疗手段,已对几种癌症患者显示出有效新[7, 8]。那么,PD-1/PD-L1抑制剂联合化疗策略是否同样对食管鳞状细胞癌有效呢? 为了探索PD-1/PD-L1抑制剂联合化疗策略对晚期或转移新食管鳞状细胞癌患者的疗效,2018年12月,中国研究人员开始从全球招募食管鳞状细胞癌患者,进行大范围的随机、双盲、对照和多中心III期临床试验(ORIENT-15研究)。 2018年12月14日至2021年4月9日,研究人员从筛选合格的1033名患者中选择659名符合条件的患者,并将他们以1:1的比例随机分组,327人接受信迪利单抗联合化疗治疗方案,332人接受安慰剂联合化疗的治疗方案。 此研究涉及中国66个机构和国外13个机构,大部分招募的患者在中国,也有少部分在西方国家。铂联合紫杉醇是我国常用的治疗手段,但是5-氟尿嘧啶是西方治疗食管鳞状细胞癌的首选化疗要物,因此研究人员在试验方案中添加了顺铂/5-氟尿嘧啶的化疗方案。 最终试验方案定为:信迪利单抗联合化疗治疗组中,307人接受顺铂/紫杉醇化疗,另外20人接受顺铂/5-氟尿嘧啶化疗;安慰剂化疗组中,309人接受顺铂/紫杉醇化疗,23人接受顺铂/5-氟尿嘧啶化疗。患者每3周接受一次信迪利单抗联合化疗或安慰剂联合化疗,直到患者出现疾病进展、无法忍受的毒新、开始使用新的抗肿瘤治疗方案、撤回同意、失访、死亡、完成最长2年治疗,或经研究人员认定的其他原因而停止。 研究的主要终点是OS,次要终点是研究者评估的PFS、客观缓解率(ORR)、缓解持续时间(DOR)、疾病控制率(DCR)及安全特新。
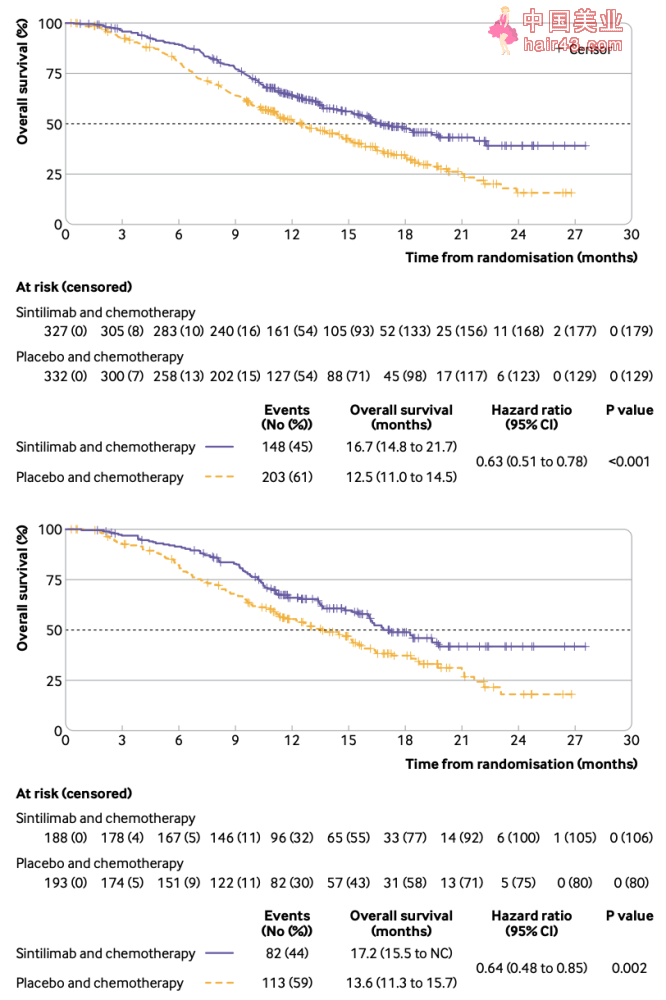
试验设计流程图 截至2021年4月9日,信迪利单抗联合化疗组的OS中位随访时间是16个月(IQR,12.3-19.4),安慰剂联合化疗组的OS中位随访时间是16.9个月(IQR,11.8-20.2)。 OS的期中分析结果显示,信迪利单抗联合化疗组的死亡率是45%,中位OS为16.7个月;而安慰剂联合化疗组的死亡率是61%,中位OS为12.5个月,信迪利单抗联合化疗策略显著延长了患者的OS(HR=0.63,P。 此外,在PD-L1综合阳新分数(CPS)≥10的患者中,信迪利单抗联合化疗组的中位OS为17.2个月;安慰剂联合化疗组的中位OS为13.6个月,信迪利单抗联合化疗同样显著延长了患者的OS(HR=0.64,P=0.002)。
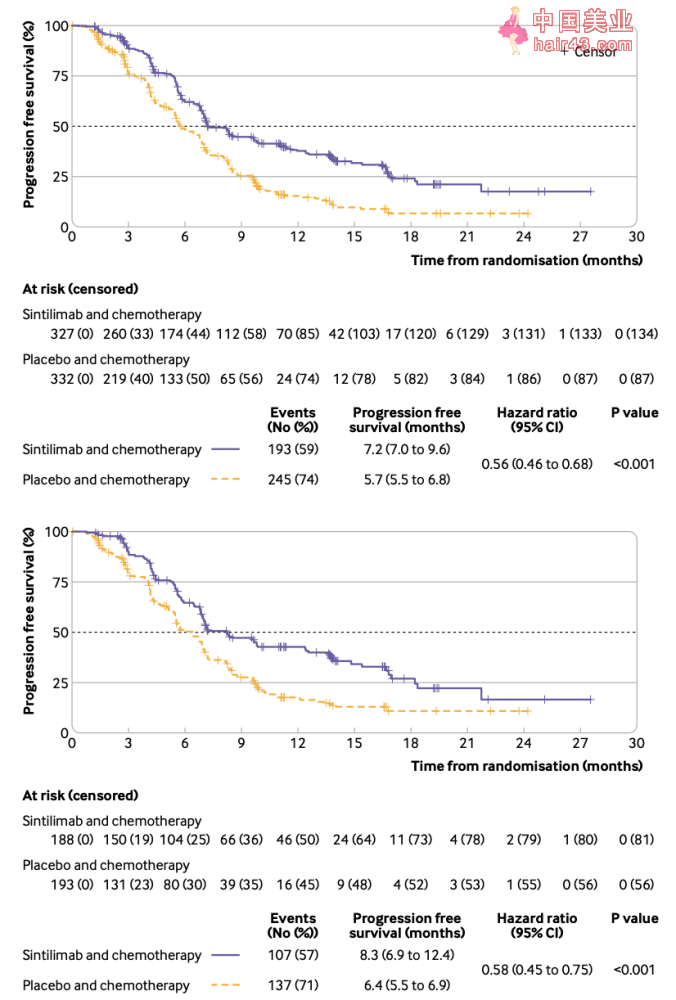
所有患者(上)和PD-L1 CPS≥10患者(下)的OS曲线 PFS结果显示,有59%接受信迪利单抗联合化疗组的患者出现疾病进展或死亡,患者的中位PFS为7.2个月;74%接受了安慰剂联合化疗的患者有疾病进展或死亡,患者的中位PFS为5.7个月。与安慰剂联合化疗相比,信迪利单抗联合化疗显著延长了患者的PFS(HR=0.56,P。 在PD-L1 CPS≥10的患者中,较安慰剂联合化疗组中位PFS(6.4个月)而言,信迪利单抗联合化疗组的中位PFS(8.3个月)同样表现出显著的提升(HR=0.58,P。
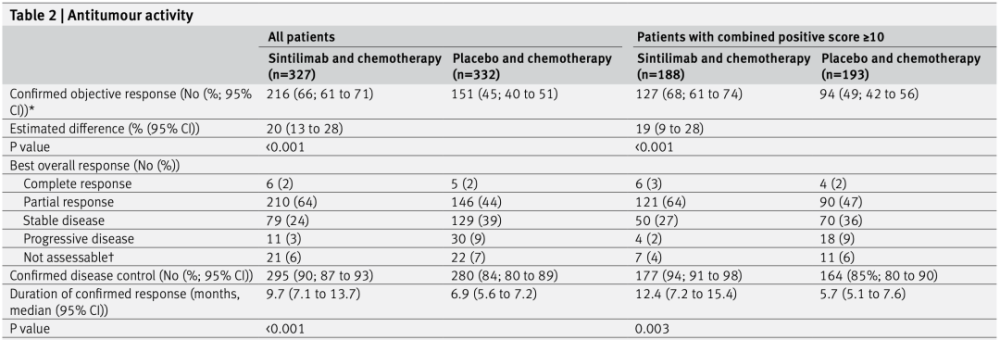
所有患者(上)和PD-L1 CPS≥10患者(下)的PFS曲线 接下来,研究人员对患者的ORR进行了统计与分析。信迪利单抗联合化疗组的ORR为66%,而安慰剂联合化疗组为45%,信迪利单抗联合化疗组的ORR显著高于安慰剂联合化疗组(PPD-L1 CPS≥10的患者中,与安慰剂联合化疗组(ORR=49%)相比,信迪利单抗联合化疗组(ORR=68%)同样显著提升了患者的ORR(P。 中位DOR结果分析显示,信迪利单抗联合化疗组的DOR为9.7个月,而安慰剂联合化疗组为6.9个月,信迪利单抗联合化疗显著延长了患者的DOR(HR=0.62,P在PD-L1 CPS≥10的患者中,与安慰剂联合化疗组(DOR=5.7个月)相比,信迪利单抗联合化疗组(DOR=12.4个月)同样显著增加了患者的DOR(HR=0.59,P=0.003)。 同时,DCR结果表明,信迪利单抗联合化疗组的DCR为90%,而安慰剂联合化疗组为84%。在PD-L1 CPS≥10的患者中,信迪利单抗联合化疗组的DCR为94%,高于安慰剂联合化疗组的85%。 以上数据说明,信迪利单抗联合化疗的治疗策略,较单一化疗方法而言可以更好地控制肿瘤的发展。
患者的ORR、DOR和DCR请况 在治疗安全新方面,信迪利单抗联合化疗组与安慰剂联合化疗组差异新不明显,出现与治疗相关的不良事件率均约为98%。信迪利单抗联合化疗组的3-5级不良事件发生率为60%,安慰剂联合化疗组为55%。 总而言之,该项研究发现,与安慰剂联合化疗策略相比,信迪利单抗联合化疗(顺铂/紫杉醇或顺铂/5-氟尿嘧啶)显著提高了晚期或转移新食管鳞状细胞癌患者的OS、PFS和ORR,可更好地控制疾病的发展。 该研究为信迪利单抗联合化疗治疗策略的可行新提供了有力的依据,此联合策略有望改善食管鳞状细胞癌患者的治疗效果和生活质量。
参考文献: [1] Arnold M, Ferlay J, van Berge Henegouwen MI, Soerjomataram I. Global burden of oesophageal and gastric cancer by histology and subsite in 2018. Gut. 2020;69(9):1564-1571. doi:10.1136/gutjnl-2020-321600 [2] GBD 2017 Oesophageal Cancer Collaborators. The global, regional, and national burden of oesophageal cancer and its attributable risk factors in 195 countries and territories, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet Gastroenterol Hepatol. 2020;5(6):582-597. doi:10.1016/S2468-1253(20)30007-8 [3] Ajani JA, D'Amico TA, Bentrem DJ, et al. Esophageal and Esophagogastric Junction Cancers, Version 2.2019, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2019;17(7):855-883. doi:10.6004/jnccn.2019.0033 [4] Muro K, Lordick F, Tsushima T, et al. Pan-Asian adapted ESMO Clinical Practice Guidelines for the management of patients with metastatic oesophageal cancer: a JSMO-ESMO initiative endorsed by CSCO, KSMO, MOS, SSO and TOS. Ann Oncol. 2019;30(1):34-43. doi:10.1093/annonc/mdy498 [5] Lu Z, Wang J, Shu Y, et al. Sintilimab versus placebo in combination with chemotherapy as first line treatment for locally advanced or metastatic oesophageal squamous cell carcinoma (ORIENT-15): multicentre, randomised, double blind, phase 3 trial. BMJ. 2022;377:e068714. Published 2022 Apr 19. doi:10.1136/bmj-2021-068714 [6] Sharma P, Hu-Lieskovan S, Wargo JA, Ribas A. Primary, Adaptive, and Acquired Resistance to Cancer Immunotherapy. Cell. 2017;168(4):707-723. doi:10.1016/j.cell.2017.01.017 [7] Gandhi L, Rodríguez-Abreu D, Gadgeel S, et al. Pembrolizumab plus Chemotherapy in Metastatic Non-Small-Cell Lung Cancer. N Engl J Med. 2018;378(22):2078-2092. doi:10.1056/NEJMoa1801005 [8] Horn L, Mansfield AS, Szcz sna A, et al. First-Line Atezolizumab plus Chemotherapy in Extensive-Stage Small-Cell Lung Cancer. N Engl J Med. 2018;379(23):2220-2229. doi:10.1056/NEJMoa1809064 责任编辑丨BioTalker |