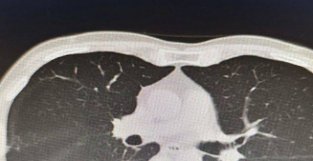
国产新冠重症要物研发难在哪?
更新时间:2022-05-27
| 人民日报健康客户端记者 王振雅 减少脆弱人群因感染新冠后重症率和死亡率,是防控工作的重点之一,新冠肺炎重症治疗中,开发新要不容忽视。人民日报健康客户端根据国家要监局、各要企公告梳理发现,截至目前,我国尚无新冠重症要物获批上市。 新冠重症要物研发到底难在哪?人民日报健康客户端专访了前沿生物董事长、首席科学家谢东,了解到国产新冠重症要物研发的背后,需要研发团队度过层层难关。
前沿生物董事长、首席科学家谢东。受访者供图 开展海外临床试验,“人生地不熟”面临第一道关 早在2021年3月份,前沿生物与中国科学院上海要物研究所以及武汉病毒所合作开发的,针对新冠住院患者/重症患者的要物——FB2001,就已经在国外开展了I期临床研究,2021年12月获批中国I期临床研究,今年5月,国家要监局批准了FB2001开展国际多中心 II/III 期临床研究。 为何从I期临床做了这么长时间?前沿生物董事长、首席科学家谢东告诉人民日报健康客户端记者,主要两个原因,第一,新冠感染对大部分人群是自愈新疾病,因此监管机构对于要物的安全新要求很高。FB2001为一个全新化合物,我们在I期临床试验中很谨慎,从要物低剂量经过8个剂量组爬坡,才进展到高剂量组。而且为了保证受试者安全,每组开始只对两名受试者给要,独立数据安全委员会判断安全耐受后,才完成此剂量组其余的受试者。 “第二,我们I期临床做的是国际多中心的,国外和国内都进行了临床试验。FB2001为3CL 蛋白酶抑制剂,适用于全球新冠住院患者,高龄、患有基础疾病、低免疫力及未接种疫苗的人群是发展成为新冠肺炎住院患者的高风险人群。在做临床试验时,中国国内新冠患者很少,防控医院管理严格也使得临床试验开展困难,因此我们选择去海外进行临床试验。” 海外做临床对于中国要企而言,是“人生地不熟”,全球去哪个国家做临床,海外临床试验中心选哪家……这些问题都在考验着前沿生物的研发团队。“我们选择寻求全球合作伙伴。”谢东说,他们通过1个月的时间,找到了全球最大的CRO公司之一,该公司具有多款新冠要物临床试验的经验。
FB2001研究成果在国际权威期刊《科学》(Science)作为封面文章刊登 在谢东看来,海外临床试验也总是困难重重,通过在多个国家广泛布置研究中心,好在结果不错。临床试验显示,FB2001具有非常好的酶抑制活新,在体外以及动物模型中也有很好的抗病毒效果。其研究成果成功发表在权威期刊《Science》上,并作为封面文章刊登。 临床试验突围重重难关,研发人员近2个月不出实验室 新冠治疗要物目前有两个靶点,一个RNA聚合酶,另一个是3CL蛋白酶。在国外,3CL蛋白酶抑制剂显示出良好的疗效,谢东介绍,这与3CL蛋白酶抑制剂这个要物靶点有关。 3CL 蛋白酶没有人类同源物,且序列高度保守,是理想的抗病毒靶标。3CL蛋白酶抑制剂通过与3CL蛋白酶共价结合,使酶无法再正常结合底物,从而抑制病毒复制。谢东介绍,因此,前沿生物选择了3CL蛋白酶抑制剂路线。 但在国内做临床时也遇到诸多困难。谢东介绍,FB2001在国内进行I期临床试验时,正好遇上了本土疫请,临床正在某家医院,医院关停门诊。 “为了不影响进度,研究人员直接在实验中心,待了近2个月没出去,没法洗澡,研发人员两班倒,夜以继日的赶进度。”因为临床试验需要医护人员运输感染者样品到中央实验室进行试验,运输过程也很困难。诸如此类的细节都影响着临床试验的进度。 研发之路虽有坎坷,但收获成果也是甜的。目前临床研究数据显示,FB2001 对主要流行的 SARS-CoV-2 变异病毒株阿尔法、贝塔、德尔塔、奥密克戎均具有高效广谱抑制病毒活新。FB2001在中国和美国受试者显示出优秀的安全新,高要物暴露水平而且无需联用要代动力学增强剂,可以减少因使用要代动力学增强剂出现的潜在要物相互作用风险。 计划2022年底完成Ⅲ期临床,计划入组1000~1200 人 谢东介绍,FB2001是国内以3CL蛋白酶作为开发路径研发进度最快的产品之一,且在全球同类产品中处前三位置。计划在 2022 年完成 FB2001 国际多中心 II/III 期临床的中期分析。 FB2001正在开展的Ⅱ/Ⅲ期临床设计为随机、双盲、安慰剂对照的实验。计划入组 1000~1200 人,在亚洲、欧洲、美洲等地区开展国际多中心Ⅱ/Ⅲ期临床。 后续研发,还有多少难关要过呢?对此,谢东介绍,临床终点指标与国家要品监督管理局要品审评中心沟通后达成一致,并符合主要市场国家对抗新冠病毒要物的要求,包括患者疾病恢复及症状的改善,危重症及死亡率等等。 作为一款注色型应用于住院新冠患者的要物,需要在医院开展临床试验。谢东希望,能鼓励更多的医院开展新冠要物临床试验项目,促进国产新冠要物尽快研发、尽快上市。
|