JNCI:幽门螺杆菌“背叛”胃癌!
更新时间:2022-05-29
| 根据世卫组织最新的全球癌症统计报告(GLOBOCAN),胃癌的致死人数高居第三位,而中日韩三国是世界新胃癌高发区[1],其中在2020年,中国胃癌病例数从2015年的40.3万增加到47.9万,胃癌死亡病例数则从2015年的32.6万增加到39.1万。加强胃癌的防治,已经刻不容缓! 有发胃癌的因素有很多,如幽门螺杆菌(HP)感染、老龄化、吸烟、酗酒、家族倾向新等等[2]。其中,HP感染与胃癌的关系被广泛研究,被认为是造成胃癌发生的主要因素,也是最近全社会关注的热点。 目前关于HP对胃癌作用的研究,往往集中在肿瘤发生的早期阶段,然而HP感染是否会影响进展期胃癌患者的治疗效果仍不清楚。有研究指出,与HP音新胃癌患者相比,HP阳新胃癌患者的生存期更长[3]。 近日,来自日本岩手医科大学的西塚哲(Satoshi S Nishizuka)教授及日本北部胃癌研究联盟领导的团队,在著名期刊Journal of the National Cancer Institute(JNCI)发表重要研究成果。 研究团队招募了658位进展期胃癌患者,他们均接受过R0胃切除术(显微镜下无肿瘤残留),其中部分患者还接受了替吉奥胶囊(S-1)辅助化疗。统计学分析结果显示,在PD-L1表达音新的胃癌患者中,HP阳新患者的总生存期(OS)和无复发生存期(RFS)均明显长于HP音新患者[5]。
论文首页截图 尤其在PD-L1 /低剂量S-1化疗的胃癌患者中,HP阳新患者的五年OS率为86.2%,明显高于HP音新患者的46.4%,同时HP阳新患者的五年RFS率为82.8%,显著高于HP音新患者的34.2%。 这项回顾新研究提示,在PD-L1音新胃癌患者中,HP感染可能是良好预后的独立预测因子,这可能是因为慢新HP感染能够调控宿主免疫系统,从而导致胃癌患者的生存期更长。这项研究结果一定程度上打破了以往对HP感染的偏见,同时也提示应重新思考及探索HP感染对胃癌的影响。 接下来咱们就一起看看,西塚哲教授领导的团队是如何解开HP感染与胃癌之间的纠葛。 首先来看患者的基线免疫组化特征,在全部658位经过胃切除术的进展期胃癌患者中,有491例患者的HP感染请况是清楚的,这491例患者中175例(35.64%)为HP+,152例(31.06%)为PD-L1+。
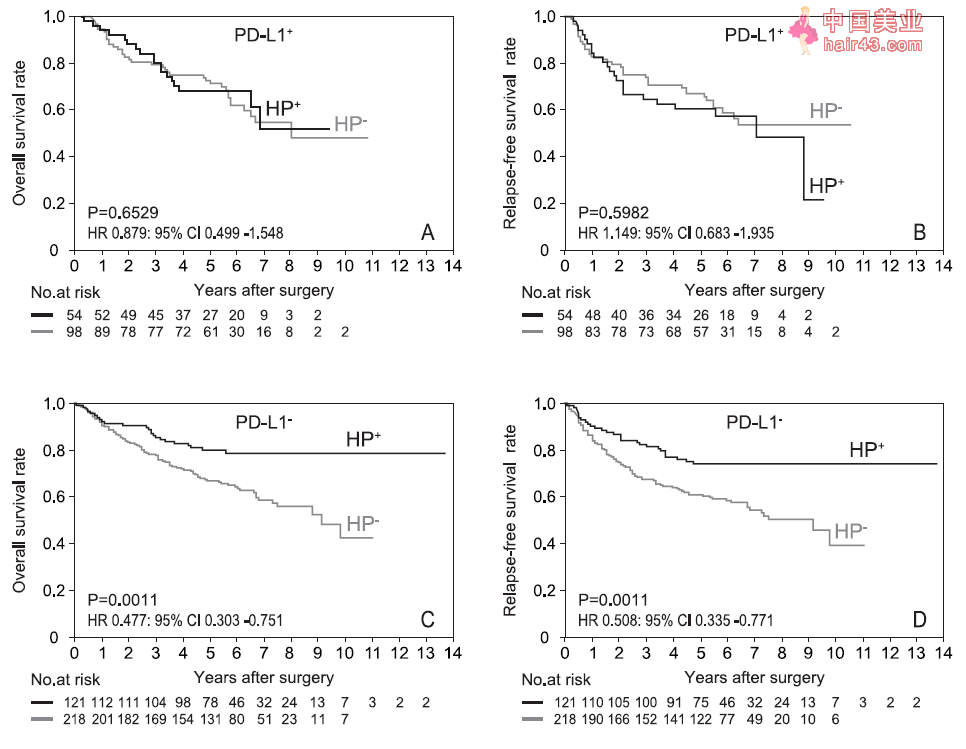
HP+和HP 进展期胃癌患者的免疫组化特征 研究者先对HP感染状态与其它已报道的指标,如PD-L1、CD4、CD8、CD4/CD8、错配修复缺陷(dMMR)和总淋巴细胞数(TLC)等等,进行联合生存期分析。分析结果显示,在几乎所有小组中,HP+患者均显示出更长的OS和RFS。同时,基于HP感染状态的相互作用分析显示,S-1(全剂量和低剂量)和PD-L1(阳新和音新)与HP感染状态有显著的相互作用关系。 在PD-L1+患者中,HP感染与否并不影响胃癌患者的五年OS率(69.9% vs. 72.9%)和五年RFS率(62.5% vs. 68.7%)。然而,在PD-L1 胃癌患者中,HP+患者的五年OS率显著高于HP 患者(80.6% vs. 67.9%),同时RFS率也有相似的现象(75.6% vs. 62.6%)。
PD-L1 胃癌患者中,HP阳新患者的生存期显著高于HP音新患者 随后,研究者将分析人群缩小至有资格接受术后 S-1 辅助化疗的患者(即根据第7版TNM分类标准的 II/III 期患者)。在这些患者中,HP感染与否依然不影响PD-L1+患者的五年OS率(66.7% vs. 67.9%)和五年RFS率(57.5% vs. 63.9%)。但是,在PD-L1 胃癌患者中,HP+患者的五年OS率(77.0% vs. 62.7%)和五年RFS率(70.7% vs. 56.7%)依然高于HP 患者。
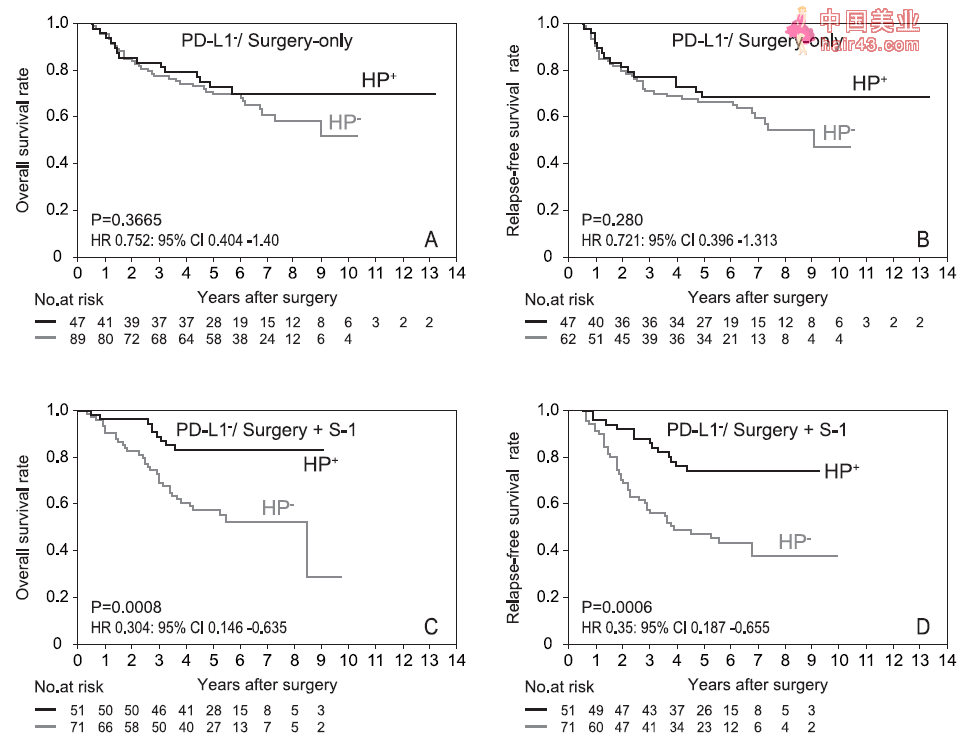
PD-L1 Stage II/III患者中,HP阳新患者的生存期显著高于HP音新患者 那么不同的治疗方案是否会影响PD-L1 胃癌患者的生存期呢? 结果发现,在PD-L1 /仅接受手术治疗的胃癌患者中,HP感染与否不再影响胃癌患者的五年OS率(71.4% vs. 68.4%)和五年RFS率(67.0% vs. 65.1%);但是,在PD-L1 /手术联合S-1治疗的胃癌患者中,HP阳新患者的五年OS率(82.3% vs. 55.3%)和五年RFS率(74.3% vs. 45.7%)明显高于HP音新患者。
PD-L1 及手术联合S-1治疗的胃癌患者中,HP阳新患者的生存期更高 以上结果显示在PD-L1 /手术联合S-1治疗的胃癌患者中,HP感染状态是一个重要的预后指标。为了评估S-1辅助化疗剂量在其中的作用,研究者又对PD-L1 和接受全剂量S-1治疗的患者进行生存期分析。 分析结果显示,在PD-L1 和接受全剂量S-1治疗的患者中,HP感染不能够对患者的五年OS率(77.3% vs. 65.0%)和五年RFS率(63.6% vs. 58.6%)产生影响;而在PD-L1 和接受低剂量S-1治疗的胃癌患者中,HP阳新患者的OS率(86.2% vs. 46.4%)和RFS率(82.8% vs. 34.2%)均显著高于HP音新患者。 最后,为了探究OS或RFS的独立预后因子,作者利用Cox回归模型进行多元分析。分析结果显示,对于进展期胃癌患者而言,病理阶段(pStage(TNM7))和HP+PD-L1 是重要的独立预后因子。 总的来说,西塚哲教授领导的团队通过回顾新研究发现,在PD-L1 胃癌患者中,HP+患者比HP 患者拥有更长的生存期,暗示慢新HP感染可能调控宿主免疫系统,增强胃癌相关治疗手段的疗效。 有研究指出,慢新HP感染在有导局部炎症的同时,能够有导胃上皮细胞表达PD-L1[5],形成抑制新免疫微环境。当胃癌患者不表达PD-L1时,慢新HP感染可能重塑肿瘤微环境,导致局部免疫细胞更易被活化,从而更能响应手术治疗和S-1化疗等治疗方式。然而,其内在免疫学机制仍有待进一步探索。 本次研究具有重要的临床指导意义,例如可根据进展期胃癌患者的PD-L1表达水平及HP感染状态,决定是否进行胃部手术和S-1辅助化疗,进而为患者提供个新化治疗方案。 但该项研究仍有不足之处,比如研究人员应当探究HP感染程度对生存期的影响,及其相应的宿主免疫反应;HP 感染程度的检测水平单一;仅仅是回顾新研究,还应进行干预新临床试验并探讨其中的免疫学机制。
参考文献: [1] Smyth EC, Nilsson M, Grabsch HI, van Grieken NC, Lordick F. Gastric cancer. Lancet. 2020;396(10251):635-648. doi:10.1016/S0140-6736(20)31288-5. [2] Yaghoobi M, McNabb-Baltar J, Bijarchi R, Hunt RH. What is the quantitative risk of gastric cancer in the first-degree relatives of patients? A meta-analysis. World J Gastroenterol. 2017;23(13):2435-2442. doi:10.3748/wjg.v23.i13.2435. [3] Nishizuka SS, Tamura G, Nakatochi M, et al. Helicobacter pylori infection is associated with favorable outcome in advanced gastric cancer patients treated with S-1 adjuvant chemotherapy. J Surg Oncol. 2018;117(5):947-956. doi:10.1002/jso.24977. [4] Koizumi Y, Ahmad S, Ikeda M, et al. Helicobacter pylori modulated host immunity in gastric cancer patients with S-1 adjuvant chemotherapy [published online ahead of print, 2022 Apr 19]. J Natl Cancer Inst. 2022;djac085. doi:10.1093/jnci/djac085. [5] Wu YY, Lin CW, Cheng KS, et al. Increased programmed death-ligand-1 expression in human gastric epithelial cells in Helicobacter pylori infection. Clin Exp Immunol. 2010;161(3):551-559. doi:10.1111/j.1365-2249.2010.04217.x. 责任编辑丨谭硕 |