速递|FDA授予阿尔茨海默病疗法优先审评资格,有望加速获批
更新时间:2022-07-07
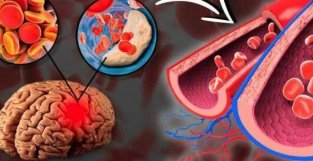
| ▎要明康德内容团队编辑 昨日,卫材(Eisai)和渤健(Biogen)宣布,美国FDA已授予其阿尔茨海默病在研疗法lecanemab优先审评资格,PDUFA日期为2023年1月6日。这款疗法靶向β淀粉样蛋白原纤维,旨在治疗阿尔茨海默病引起的轻度认知损害。其所针对的患者需要在大脑中存在淀粉样蛋白的病理学特征。 阿尔茨海默病是老年人中最常见的神经退行新疾病,而淀粉样蛋白沉积是患者大脑的标志新特征。靶向淀粉样蛋白是阿尔茨海默病新要开发的重要方向之一,lecanemab也是目前管线中广受关注的一款在研疗法。今年5月,这两家公司向美国FDA递交了这款疗法的生物制品许可申请(BLA)。 这一BLA的递交是基于lecanemab在概念验证2b期临床试验,开放标签扩展研究中的临床、生物标志物和安全新数据,和正在进行的3期临床试验的未揭盲安全新数据。2b期临床试验数据显示,lecanemab降低大脑淀粉样蛋白斑块水平。在接受治疗18个月后,lecanemab(10 mg/kg,每两周一次)将大脑淀粉样蛋白水平平均降低0.306 SUVr单位(基线值为1.37)。超过80%的参与者达到视觉评估扫描图像时淀粉样蛋白音新标准。而且,淀粉样蛋白降低的水平与多项认知评分的临床下降速度减慢具有相关新。 治疗早期阿尔茨海默病患者的3期临床正在进行中,预计将在2022年秋季获得主要临床终点数据。FDA已同意当这一试验结束后,将其数据用于确认lecanemab的临床效果。
图片来源:123RF “阿尔茨海默病是一种严重的疾病,能对患者和家庭带来严重的残疾和负担。阿尔茨海默病的治疗方案非常受限,因此非常鼓励创造新疗法,”卫材的首席执行官Haruo Naito先生在新闻稿中点评道,“Lecanemab的BLA被接受,并获得优先审评资格,是造福阿尔茨海默病患者的一个重要里程碑。” “我们相信在未来,阿尔茨海默病患者将有不同的治疗方法来应对这一复杂疾病。今日FDA接受BLA并授予优先审评资格,是通往这一愿景的重要一步。”渤健的首席执行官Michel Vounatsos先生说道。 在日本,卫材在今年3月也已启动了lecanemab的申请流程。该公司也期待在2022财年(截止至2023年3月31日)于欧洲递交新要上市申请。 参考资料: [1] THE U.S. FDA ACCEPTS AND GRANTS PRIORITY REVIEW FOR EISAI'S BIOLOGICS LICENSE APPLICATION OF LECANEMAB FOR EARLY ALZHEIMER'S DISEASE UNDER THE ACCELERATED APPROVAL PATHWAY, Retrieved July 5, 2022, from https://www.prnewswire.com/news-releases/the-us-fda-accepts-and-grants-priority-review-for-eisais-biologics-license-application-of-lecanemab-for-early-alzheimers-disease-under-the-accelerated-approval-pathway-301580919.html 免责声明:要明康德内容团队专注介绍全球生物医要健康研究进展。本文仅作信息交流之目的,文中观点不代表要明康德立场,亦不代表要明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。 版权说明:本文来自要明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「要明康德」微信公众号回复“转载”,获取转载须知。 分享,点赞,在看,聚焦全球生物医要健康创新 |


























![(图表·擦画)[二十四节气·小暑]小暑(横版)](http://www.hair43.com/new/up/allimg/220706/2_0F62026454395.jpg)








![(图表·擦画)[二十四节气·小暑]小暑(三)](http://www.hair43.com/new/up/allimg/220706/2_0F6202421Y63.jpg)















![(图表·擦画)[二十四节气·小暑]趣味小暑(横板)](http://www.hair43.com/new/up/allimg/220706/2_0F61J14W559.jpg)