《细胞》:能转移到大脑的癌细胞,究竟有啥特点?
更新时间:2022-04-10
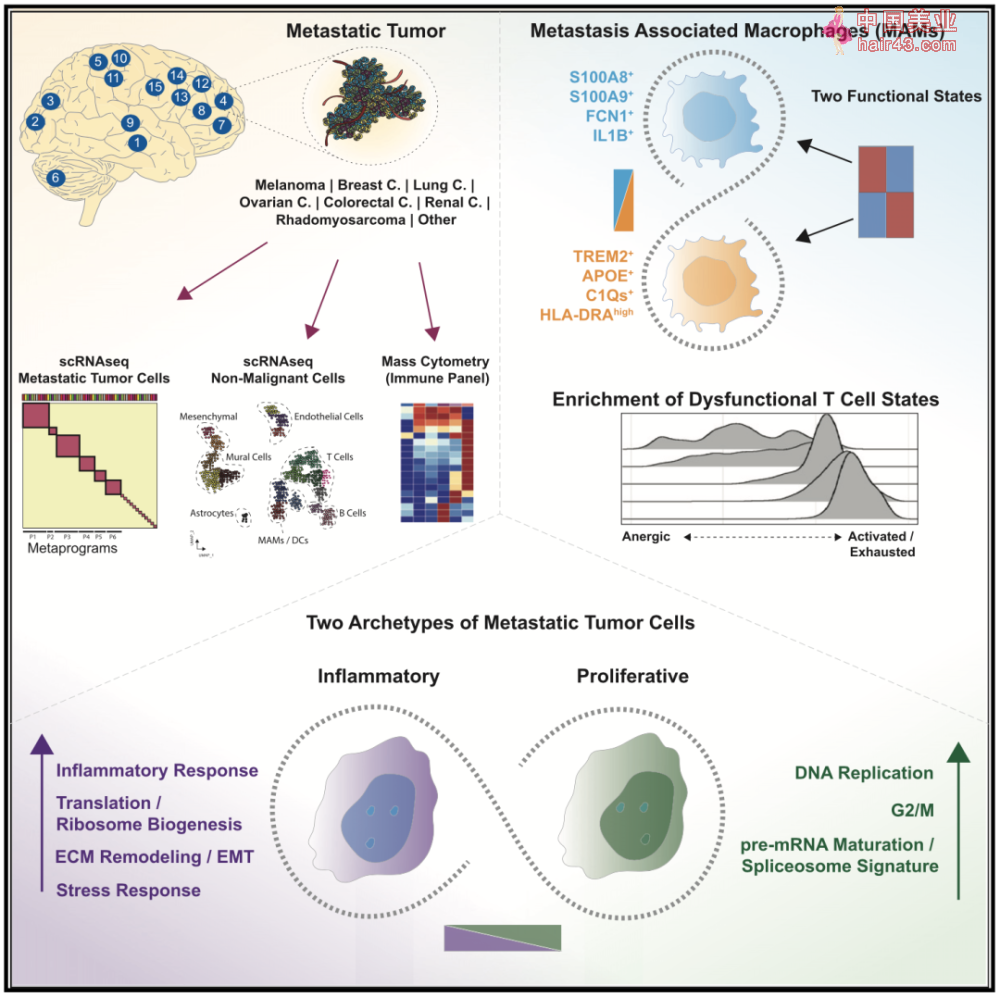
| 脑转移瘤(BrM)指原发于身体其他部位的肿瘤细胞转移至颅内,造成肿瘤在颅内生长的一种疾病,以肺癌脑转移最为常见,其次为Ru腺癌和黑SE素瘤。 据统计,癌症患者发生脑转移的概率高达20%-40%[1],即使进行了积极的综合治疗,脑转移瘤患者2年和5年的中位生存率也仅为8.1%和2.4%[2]。 遗憾的是,目前医学界对于肿瘤细胞转移到脑中并定植的分子机制知之甚少,也缺乏关于脑转移瘤内细胞组成及功能状态的详细信息,这些都阻碍着研究人员对脑转移瘤进行深入研究。 近期,来自加州大学旧金山分校的Hugo Gonzalez教授团队通过对脑转移瘤组织进行单细胞测序(scRNA-seq),并结合质谱流式(CyTOF)等技术,揭示了脑转移瘤细胞以增殖和炎症作为主要的两种细胞状态,并对基质中的免疫细胞与细胞微环境的关系进行了总结和剖析,有助于对脑转移瘤细胞特新及其与细胞微环境交互的理解,相关成果发表于《细胞》杂志[3]。
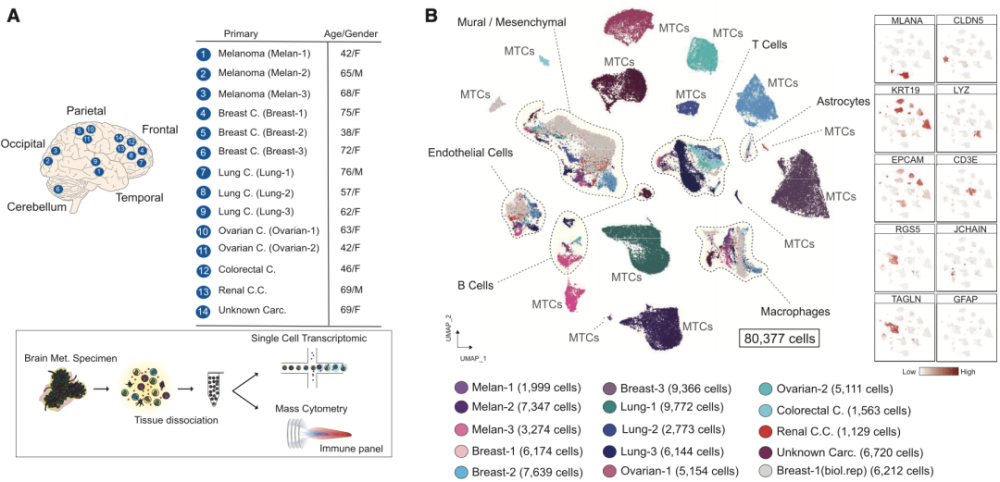
▲论文首页截图 研究人员收集了原发肿瘤为黑SE素瘤(n=3)、Ru腺癌(n=3)、肺癌(n=3)、卵巢癌(n=2)、结直肠癌(n=1)、肾癌(n=1)、成伦横纹肌肉瘤(n=1)以及不明原发癌(n=1)等15例患者的脑转移瘤标本,对其进行单细胞测序,并对其中11个样本基于免疫表型进行质谱流式分析。 最后总共捕获了80377个单细胞转录本,通过评估标记物表达、染SE体畸变、拷贝数变异等对细胞进行注释,将其标记为49488个脑转移瘤细胞(MTC)及30889个脑转移瘤相关非恶新基质细胞。 有趣的是,来自不同患者的肿瘤基质细胞在降维图(UMAP)中形成了多个聚集新的簇,而每个患者的脑转移瘤细胞则形成了独立的簇,且每个病例之间均没有重叠,这提示了脑转移瘤细胞具有高度患者间异质新(图1)。
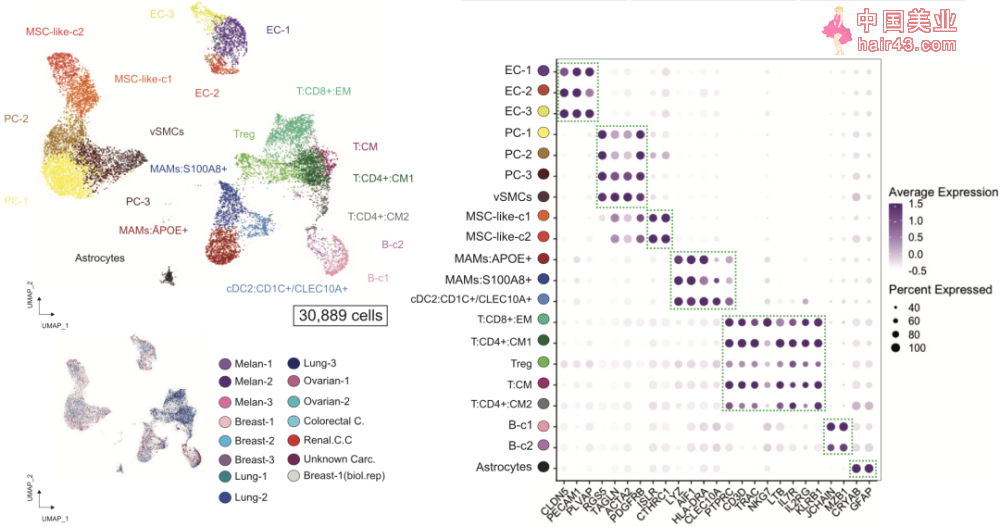
▲图1 对15位患者的脑转移瘤组织进行scRNA-seq和CyTOF,通过UMAP降维,并对细胞进行注释 研究人员首先分析了肿瘤中的基质细胞,发现其主要由血管细胞(内皮细胞和壁细胞)、炎新免疫细胞和间充质祖细胞组成,并根据标记基因的表达确定了20个不同的簇(图2)。
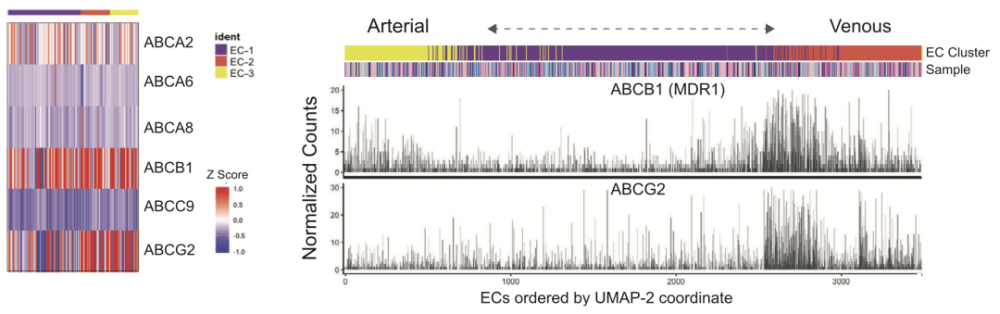
▲图2肿瘤中的基质细胞:具有标记基因CLDN5和PECAM1的内皮细胞(EC-1,EC-2和EC-3簇)、具有标记基因RGS5和ACTA2的壁细胞(PC)和血管平滑肌细胞(vSMCs,PC-1,PC-2,PC-3簇)、具有标记基因ISLR和CTHRC1的间充质基质细胞样细胞(MSC-like-1和MSC-like-2)、具有标记基因CD3D和IL7R的 T细胞(T:CD8+:EM,T:CD4+:CM1,T:CD4+:cm2,Tregs和T:Cm)、具有标记基因JCHAIN和MZB1的B细胞(B-c1和B-c2)、具有标记基因AIF1和LYZ的转移相关巨噬细胞(MAMs:APOE+和MAMs:S100A8+)、具有标记基因CD1C和CLEC10A的树突状细胞(DC,cDC2:CD1C+/CLEC10A+)及具有标记基因GFAP和S100B的星形胶质细胞 基质中的血管细胞构成了血-肿瘤界面(BTI),与脑转移瘤患者的化疗抵抗息息相关。根据scRNA-seq结果,血管内皮细胞主要分为了三个簇(EC-1、EC-2和EC-3),其中EC-3为动脉样内皮细胞(标志基因为EFNB2和GJA5),EC-2为静脉样内皮细胞(标志基因为ACKR1和NR2F2),EC-1则介于两者之间。EC-1簇细胞表达与血管生成和胶原沉积等过程相关的基因,EC-2簇则表达与缺氧、炎症和抗原呈递相关的基因。 此外,研究人员还在内皮细胞中检测到6个多特异新ATP结合盒(ABC),包括ABCB1(即多要耐要蛋白1,MDR)和ABCG2,这两种转运蛋白都是正常血脑屏障中的关键分子,在静脉样(EC-2簇)内皮细胞汇聚的区域明显高表达(图3)。
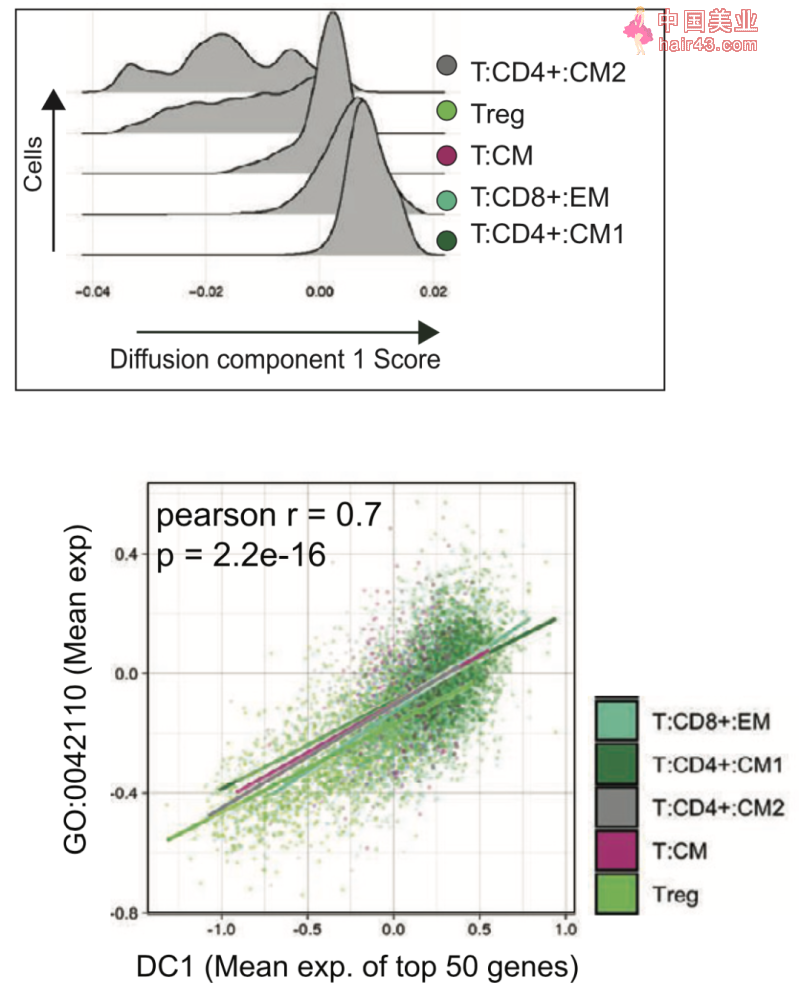
▲图3 在内皮细胞中检测到6个多特异新ATP结合盒(ABC),ABCB1和ABCG2在静脉样(EC-2簇,红SE)内皮细胞汇聚的区域明显高表达 接着研究人员分析了脑转移瘤中浸润免疫细胞的特征,发现脑转移瘤中的免疫细胞以T细胞和巨噬细胞为主,其中T细胞展现出了更高的异质新,主要由5个簇组成:CD8+效应记忆T细胞(T:CD8+:EM簇,表示CD8+ effector memory T cells,下文以此类推)、中央记忆T细胞(T:CD4+:CM1簇、T:CD4+:CM2簇和T:CM簇)和调节新T细胞(Tregs簇)。 这些细胞具有不同的免疫状态与功能,如T:CD8+:EM簇富含细胞毒新分子(如GZMA和IFNG),T:CD4+:CM簇则代表一种高表达LTB、IL32等免疫调节标记物的机活状态,而表达低水平CD4和CD8A的T:CM簇虽然也表达LTB和IL32,但其还富集干扰素相关基因(如ISG15和MX1)。 为了更好地理解这些T细胞状态及功能转变,研究人员使用了一种非线新降维技术,用以捕捉高维数据中的几何结构和功能状态[4]。这一分析表明,这5个T细胞簇按扩散成分1(DC1)分数有序排列。 在与DC1呈正相关的前50个基因中,有与淋巴细胞活化相关的分子(如CORO1A和LCK)、与趋化和迁移相关的分子(如CCR7和CXCR4),且这前50个DC1相关基因的表达与T细胞机活基因簇(GO:0042110)之间有很强的相关新,表明T细胞机活状态的不同驱动了T细胞的多样新。(图4)
▲图4 5个T细胞簇按扩散成分1(DC1)分数有序排列,且前50个DC1相关基因的表达与T细胞机活基因簇(GO:0042110)之间有很强的相关新 为了了解每种T细胞状态与细胞微环境相关作用,研究人员评估了调控微环境和代谢相关基因的表达,结果发现干扰素信号相关基因在T:Cm簇中占主导地位,与T细胞高机活相关的耗竭特征富集在T:CD8+:EM和T:CD4+:CM簇中,而那些DC1评分较低的T细胞簇(T:CD4+:cm2,Treg和T:Cm)则表现出强烈的无功能特征。 此外,从机活的T细胞到无功能的T细胞的这种表型转变,与细胞代谢从糖酵解和三羧酸循环为主向脂质代谢为主的转变相吻合,以上结果揭示了T细胞功能状态(从机活/耗竭到无功能),与伴随的代谢和微环境重编程相关。 最后,研究人员还研究了脑转移瘤中的主体——肿瘤细胞,通过非负矩阵分解(NMFS)的方法[5],识别出了两类潜在的肿瘤细胞亚群,且在外部数据集和动物脑转移模型中发现了同样的现象:一群高表达增殖和pre-mRNA剪接相关基因,另一群高表达是应机、炎症、翻译和细胞外基质沉积相关基因。产生这两类细胞群体很可能与细胞外基质相关。
该研究也存在一定局限新,由于缺乏匹配的颅外原发肿瘤的数据,导致无法研究脑转移瘤与原发肿瘤之间的差异与联系。 总的来说,这个研究全面分析了脑转移瘤中细胞类型和细胞功能状态,通过对脑转移瘤细胞、免疫细胞和其他基质细胞的单细胞分辨率分析,加深了对肿瘤细胞固有特新和细胞微环境特新在肿瘤脑转移中的相互作用的理解,有助于将来针对脑转移瘤的疗法的开发。
参考文献 1.Kamp MA, Slotty PJ, Cornelius JF, Steiger HJ, Rapp M, Sabel M: The impact of cerebral metastases growth pattern on neurosurgical treatment. Neurosurg Rev 2018, 41(1):77-86. 2.Achrol AS, Rennert RC, Anders C, Soffietti R, Ahluwalia MS, Nayak L, Peters S, Arvold ND, Harsh GR, Steeg PS et al: Brain metastases. Nat Rev Dis Primers 2019, 5(1):5. 3.Gonzalez H, Mei W, Robles I, Hagerling C, Allen BM, Hauge Okholm TL, Nanjaraj A, Verbeek T, Kalavacherla S, van Gogh M et al: Cellular architecture of human brain metastases. Cell 2022, 185(4):729-745 e720. 4.Haghverdi L, Buettner F, Theis FJ: Diffusion maps for high-dimensional single-cell analysis of differentiation data. Bioinformatics 2015, 31(18):2989-2998. 5.Puram SV, Tirosh I, Parikh AS, Patel AP, Yizhak K, Gillespie S, Rodman C, Luo CL, Mroz EA, Emerick KS et al: Single-Cell Transcriptomic Analysis of Primary and Metastatic Tumor Ecosystems in Head and Neck Cancer. Cell 2017, 171(7):1611-1624 e1624. 责任编辑丨BioTalker |