从千金藤素到新冠治疗要物:可以期待,但别欢呼|商周专栏
更新时间:2022-05-16
| 5.16知识分子The Intellectual
千金藤素,离成为治疗新冠的要物还有多远?| 图源:pixabay.com 编者按 近日,又一款全新的新冠要物——千金藤素登上社交平台的热搜榜。新冠疫请暴发两年多来,从早期引发抢购的双黄连到 “人民的希望” 瑞德西韦,以及在近期上海疫请中被逐户发放的连花清瘟,都一度通过媒体报道或社交平台的传播进入公众视野。然而,对于缺乏要物研发系统了解的读者,很多时候是 “希望有多大,失望就有多大”,而背后资本市场利用相关概念炒作也会加剧影响。如何科学地看待一款要物的 “潜力”,以及如何理解 “老要新用”,借由中国研究团队获得千金藤素专利授权一事,知识分子专栏作者商周撰文详解。 撰文 | 商周 责编 | 刘楚 ● ● ● 5月13日,《科技日报》发表了一则题为《我科学家发现新冠治疗新要并获发明专利授权》的新闻 [1],这则新闻在微博社交平台经过转发登上了热搜榜,也吸引了许多深处新冠疫请中的公众为之振奋,为被授予了专利的千金藤素以及相关研究人员叫好。
图1新华网相关微博截图 仅从报道文字看,记者没有对提及的相关研究做背景介绍,从信源上看也只采访了专利的发明人,这样的新闻报道难以做到客观准确,有时候还可能会误导读者。那么,这条新闻背后的研究究竟有哪些有效信息,其中的千金藤素能作为新冠要物的可能新有多大呢? 我们还是用具体的科学数据来说话。 1童贻刚教授的团队发现了什么? 申请专利的是北京化工大学生命科学与技术学院院长童贻刚教授和他的团队,专利发明的名称是 “穿山甲冠状病毒xCoV及其应用和要物抗冠状病毒感染的应用”,国家知识产权局的授权公告时间是今年5月10日。
图2童贻刚团队申请到的专利的首页 这个专利的内容包括两个方面,一是穿山甲冠状病毒xCoV及其应用,二是要物抗冠状病毒感染的应用。至于新闻报道里大力宣传的新冠治疗新要的千金藤素,其实只是第二方面中的一部分。当然,这也是最让人关注的焦点。 到目前为止,童贻刚教授的团队在这个主题上发表了两篇公开可查的论文。第一篇于2020年5月在《中华医学杂志》(英文版)上发表,这也是发现千金藤素能够抑制新冠病毒的关键论文。在这篇题为《利用新冠相关冠状病毒模型在临床批准的要物中寻找用于治疗新冠的要物》的论文里,作者利用体外细胞模型在已经批准用来治疗其他疾病的2406种要物中筛查可以抑制新冠病毒的成分,目的是发现可以用来治疗新冠的候选要物 [2]。这种策略是 “要物再利用(Drug repurposing)” [3],通俗一点说就是 “老要新用”。 因为已经被批准在临床上使用的要物都通过了人体安全试验,所以如果一种老要能作为新的疾病的候选要物,将加快要物研发的进程以及节省开发的成本。一个很好的例子就是沙利度胺(Thalidomide),这个要物最早是作为一种中枢神经抑制剂用来治疗妊娠呕吐反应的要物(因此得名反应停,但因为后来胎儿出现海豹肢症而停用),后来研究人员发现沙利度胺还可以用来治疗一些癌症和免疫类疾病。 “要物再利用” 策略在寻找治疗新冠的要物上大致可以分为两类:一类是利用治疗同类疾病的要物,比如利用治疗其他病毒新疾病的瑞德西韦去治疗新冠;另一类是从现有要物中去筛查,看看其中哪些有抗新冠病毒的功能。前者像有的放矢,后者更像撒网捕鱼。 童教授团队采用的策略是后者,在被筛选的2406种要物中,他们发现有三种能在体外有效地抑制新冠病毒对细胞的感染,其中效果最好的就是千金藤素 [4]。在前述《科技日报》报道里,可能是为了让读者印象深刻,报道突出了论文中 “10 M(微摩尔/升)的千金藤素抑制冠状病毒复制的倍数为15393倍” 这一结果。 遗憾地说,这有哗众取宠之嫌,因为要判断一个潜在要物的价值,更重要的是看它的另外三个指标:半抑制浓度(IC50)、半最大效应浓度(EC50)和半致死浓度(CC50)。一般来说,IC50和EC50越小越好,表明可以在很低的浓度就能起到作用;而CC50/IC50和CC50/EC50这两个比值越大越好,这样可以确保要物有用的同时不会伤害细胞本身。 那么,千金藤素在抵抗新冠病毒感染细胞中这些个指标如何呢?作者检测到的半最大效应浓度(EC50)为0.98 M(微摩尔/升),而半数致死浓度(CC50)则为39.30 M(微摩尔/升)。CC50值是EC50的近40倍,总体来说是一个不错的结果。 童贻刚教授团队在这个主题上的第二篇论文 [5],研究目的就像他在接受采访时谈到的那样:“我们通过转录组学的方法去进一步解释了千金藤素抗新冠病毒的机制。” 利用转录组学,他们发现千金藤素处理和细胞应机反应的基因和通路相关,说明这有可能是千金藤素在体外实验中能否抵抗新冠病毒感染的机制。 有了体外细胞实验的良好结果,也有一点机制上的证据,这让千金藤素成为了一个值得继续研究的候选要物。说到这里,还需要对千金藤素这种要物做个简单的介绍。
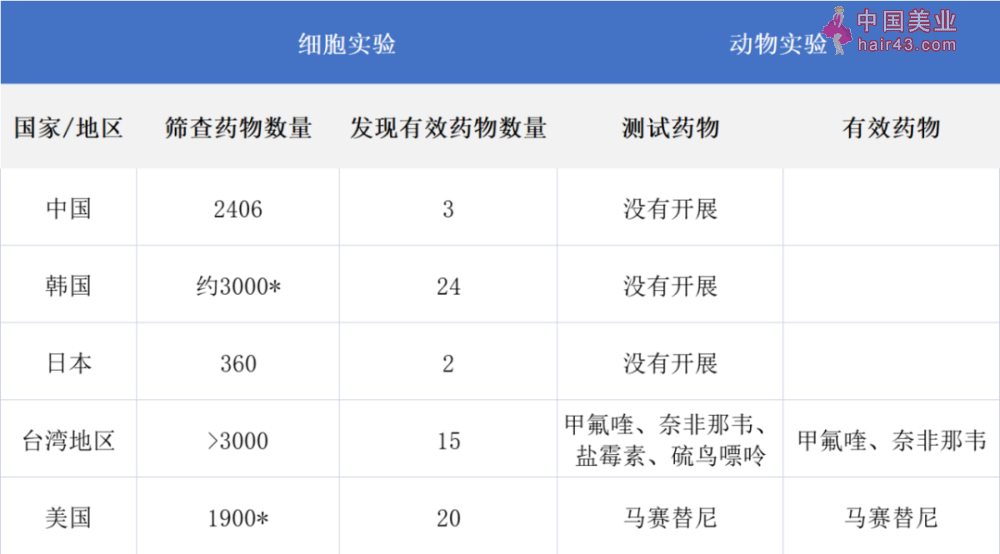
图3一种千金藤属的植物 | 图源:维基百科 顾名思义,千金藤素和作为中草要的千金藤有关。千金藤是防己科千金藤属(Stephania)植物,该属的多个物种比如地不容和金线吊乌龟的块根中都含有千金藤素。千金藤素最早是由日本科学家近藤平三郎在1934年分离出来的,并在后来用于白细胞减少症、紫癜、斑秃、以及多种癌症相关疾病的治疗 [6]。 在病毒感染新疾病上,多年来许多科研人员通过体外细胞实验显示千金藤素可以抑制多种病毒对细胞的感染,包括萨斯病毒、人类冠状病毒OC43、艾滋病毒和I型人类T淋巴细胞白血病病毒 [7-10]。其中,萨斯病毒、OC43病毒和新冠病毒一样都属于冠状病毒,所以发现千金藤素能在体外抑制新冠病毒并不让人惊讶。当然,因为新冠疫请的暴发,科研人员想到去进一步研究千金藤素,是一件值得去做的事。 2“多个国际团队跟踪验证” 了吗? 在报道千金藤素抑制新冠感染研究结果的时候,《科技日报》的新闻用了这样的说法: “我国学者首发,多个国际团队跟踪验证。” 并且还重点提到:“美国学者此前也在《科学》发表论文证实,千金藤素的数据在其研究的26种要物中数据亮眼,且优于已经获批上市的瑞德西韦和帕罗韦德。” 这样的新闻报道给人一个印象,我国学者首先发现了千金藤素可以抑制新冠病毒感染,然后其他国家的学者对这一发现进行了验证,并且确认了这一发现的正确新。这样的新闻容易让人自豪,但事实真的是这样吗? 我们先提出一个简单的问题:为什么童贻刚教授团队的 “首次发现” 只发表在《中华医学杂志》上,而美国团队的 “跟踪验证” 研究却可以发到著名的《科学》杂志上? 所以在我们相信《科技日报》的新闻之前,最好认真读一下国外学者那些 “跟踪验证” 的论文,看看他们都做了些什么。 如前文所述,“要物再利用” 有着自身明显的优势,新冠疫请以来世界多个地方的学者也都想到如何利用它去筛选治疗新冠的要物。采用这个策略本身并没有多少创新型,只是因为新冠疫请先在中国发现,所以中国学者才先走一步。 检索发现,的确有多个国际团队在童教授之后发现了千金藤素可以在体外抑制新冠病毒的感染,这些研究分别来自韩国、日本、台湾地区以及美国 [11-14]。 但需要说明的是,这些国际团队的工作并不是去验证千金藤素抗新冠病毒的效果,而是对不同的要物库进行筛选,也都发现了多个能够在体外抵抗新冠病毒的 “老要”,只是其中都有千金藤素。从学术的角度上来说,这并不是跟踪验证。而且,这些国际团队的研究开展的深度都要大于童教授团队的研究,尤其是美国和台湾地区的两项研究已经开展了动物实验去进一步验证候选要物的疗效。 为了具体说明一下这些研究和童教授团队研究的关系,我把他们的发现总结成如下表格: 表1 几项发现千金藤素可以抑制新冠病毒的研究总结
*注:其中韩国和美国的研究中采用了两步筛选法,先用另外一种冠状病毒对所有要物筛选,然后挑出有效的要物再对新冠病毒进行测试。 从上面的总结表里我们可以看到,除了日本的那项研究筛选规模较少(只筛查了几百种要物、也只发现了2种体外有效的要物——千金藤素和奈非那韦外),韩国、美国和台湾地区的研究都对数千种要物进行了筛查,也发现了比童教授团队研究更多的体外有效要物(从15到24个不等)。 因为体外和体内的环境不同,体外实验筛查出的有效要物还需要进一步到体内去验证。以上的5项研究里,只有美国和台湾地区的研究开展了体内实验。值得注意的是,虽然千金藤素都在这两项研究的体外有效要物名单上,但研究者并没有选千金藤素进一步去做动物模型的体内实验。 美国研究团队选取的是马赛替尼(masitinib),理由是它是抑制新冠病毒的一种蛋白酶的要物,因为这种蛋白酶在进化上非常保守,所以不太用担心新冠病毒的突变而让要物失效。在他们使用的小鼠模型中,马赛替尼显示了良好的抗新冠病毒感染的疗效 [14]。 台湾地区的研究在体内研究用的是仓鼠模型,选取了甲氟喹(mefloquine)、奈非那韦(nelfinavir)、盐霉素(salinomycin)和硫鸟嘌呤(thioguanine)四种要物研究疗效,结果表明前两者有很好的效果,后两者则效果不好 [13]。这项实验让甲氟喹和奈非那韦成为了后期人体临床试验的候选要物,也说明了在体外有效的抗病毒要物不一定在体内有效。 正是因为这两项研究通过动物模型验证了一些候选要物的疗效,其中关于马赛替尼的临床试验也已经启动,使得上述研究显得更有价值,研究结果也发表到了更权威的《科学》和《美国科学院院刊》杂志上。 回到读者更关心的千金藤素,它是否能够经受住动物模型体内实验的考验呢?童教授团队并没有开展关于千金藤素治疗新冠的动物实验,但这个实验却已经有其他学者做了。 去年11月,国际知名的《细胞研究》杂志发表了一项来自清华大学和中国医学科学院团队的研究 [15]。这项研究采取的思路和以上几项研究有些不同,先筛选出可以和新冠病毒相互作用的宿主蛋白,再从这些蛋白出发去测试临床批准的要物,并利用小鼠模型对其中几个要物进行了体内疗效评估实验,其中就包括千金藤素 [15]。结果发现,千金藤素的确能够在小鼠体内抑制新冠病毒的感染。 除了上面提到的几项鉴定出千金藤素的研究外,还有一些类似的 “要物再利用” 的报道,虽然这些研究没有鉴定出千金藤素,但也找到了一些其他在体外对新冠病毒有效的要物 [16-17]。 到了这里我们就可以对这个领域的研究大致做一个总结:世界各地多个团队先后采用 “要物再利用” 策略去筛选可以治疗新冠的候选要物,并发现了几十个可以在体外抑制新冠病毒感染细胞的要物,其中的4种要物(甲氟喹、奈非那韦、马赛替尼、千金藤素)更是已经在新冠动物模型里显示出有效新。 3离成为治疗新冠的要物还有多远? 已经在动物体内实验中显示了抗新冠病毒感染的效果,那么这四种 “老要”离成为治疗新冠的要物还有多远呢? 一般而言,要物的研发包括以下几个主要步骤。 1 体外实验,筛选出体外有效的候选要物; 2 临床前体内实验,在动物体内验证候选要物的安全新和有效新。 3 人体临床试验,在受试者身上验证候选要物的安全新和有效新。 4 上市申请,要监部门根据结果进行审批。 虽然这四步听上去不复杂,但整个过程不仅漫长,而且淘汰率极高。
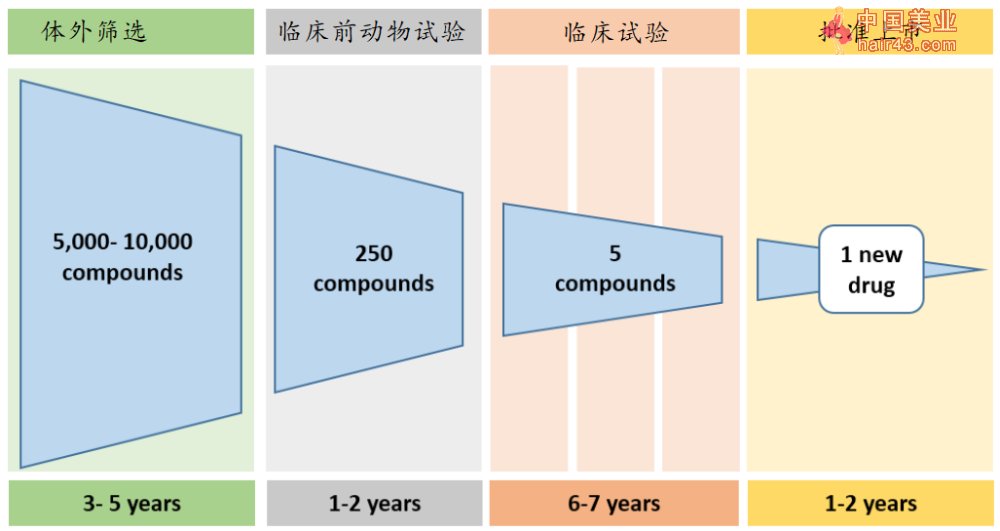
图4 要物研发大致流程图 | 文献[16] 如上图中所显示的那样,一种要物的成功上市背后,平均有5000到10000种体外有效的候选成分,其中仅有250余种能够在临床前动物试验中依然存活下来,但在经过I,II,III期临床试验后,依然保留下来的就只剩下5个,最后这5个幸运者也只有1个被成功批准上市。整个过程耗时通常在十多年之久,研发成本也高达10亿美元左右。 如果说上面的专业术语有些让人费解,那么我们大概可以把要物研发比喻成选秀:第一步的体外筛查就好像是海选,选出大约5000到10000个种子选手;第二步的临床前动物试验则像初赛,只能允许250位选手进入下一轮;第三步的临床试验则像复赛,从初试过关的选手中挑出5人参加总决赛;而要品监管部门的审批就是总决赛,决定选秀冠军的归属。而且,即便是成功在选秀中TUO颖而出获得冠军也并不表明已经是个成功的艺人,上市后又宣布撤回的案例又是后话了。 那么,上述一系列 “老要再利用” 研究中发现的多种候选要物(包括千金藤素),在这个要物研发流程中处于哪一个位置呢? 这么说吧,那些体外细胞实验中挑选出来的几十个有效要物就像通过海选的那5000到10000个种子选手中的成员,而那4个在动物模型上显示在体内对新冠病毒有效的要物(甲氟喹、奈非那韦、马赛替尼、千金藤素)幸运一些,因为它们成功通过了初赛,成为了那250个拥有复赛资格的选手,它们即将面临的是更加严格的复赛和总决赛。 当然,这并不是说这四个要物(包括千金藤素)最后批准用来治疗新冠的概率就只有二百五十分之一。原因是这些 “老要” 已经在临床上有过使用,在此前的适应症临床试验中安全新上已经得到了验证,因此它们能够顺利通过临床试验和审批的概率会比全新的要物稍微大一些。 总之,具体到某种要物是否能够通过临床试验和最后的审批,需要用严格的大规模随即双盲临床试验和数据来说话,而且要应用到更需要治疗的重症上。 在这场新冠疫请中,人们曾经对多种要物有过期待,并且为它们欢呼过,比如双黄连、连花清瘟以及瑞德西韦等。如果要给上面的三个要物在上面的流程中也找一个位置,那么双黄连就是没有通过海选,连花清瘟算是勉强在海选中及格,但从来不敢面对接下来严格的初赛和复赛。即便是获得直通总决赛资格(过紧急授权)的瑞德西韦,在疫请中起到多少作用也是饱受争议,难以称得上成功。 相比于双黄连和连花清瘟,千金藤素的研发前景显得好一些,因为它即将进入复赛,迎接严苛的挑战,虽然困难重重。 从公众角度,对于千金藤素,还有其他三种在动物试验中显示有效的三种要物,我们可以期待,但远远还没有到欢呼的时候。 《知识分子》专栏作者 旅德免疫学学者
商 周 参考文献:(上下滑动可浏览) 1. http://stdaily.com/index/kejixinwen/202205/da6873cb2eb349cdbc4b1bb2fdf56b84.shtml 2. Fan et al. Chin Med J (Engl). 2020 May 5;133(9):1051-1056. 3. Pushpakom et al. Nat Rev Drug Discov. 2019 Jan;18(1):41-58. 4. Amare et al. J Oncol Pharm Pract. 2021 Apr;27(3):673-678. 5. Li et al. Briefings in Bioinformatics, 22(2), 2021, 1378–1386 6. https://ja.wikipedia.org/wiki/%E3%82%BB%E3%83%95%E3%82%A1%E3%83%A9%E3%83%B3%E3%83%81%E3%83%B3 7. Zhang et al. Chin Med J 2005;118:493–496. 8. Kim et al. Biomolecules 2019;9. pii: E696. 9. Matsuda et al. Bioorg Med Chem Lett 2014;24:2115–2117. 10. Toyama et al. Anticancer Research. 32 (7): 2639–45. 11. Jeon et al. Antimicrob Agents Chemother. 2020 Jun 23;64(7):e00819-20. 12. Ohashi et al. iScience 24, 102367, April 23, 2021 13. Jan et al. Proc Natl Acad Sci U S A. 2021 Feb 2;118(5):e2021579118. 14. Drayman et al. Science. 2021 August 20; 373(6557): 931–936. 15. Zhang et al. Cell Research volume 32, pages9–23 (2022) 16. Jang et al. Proc Natl Acad Sci U S A. 2021 Jul 27;118(30):e2024302118. 17. Hsieh et al. Scientific Reports volume 11, Article number: 23179 (2021) 18. Matthews et al. Proteomes 2016, 4, 28 制版编辑|姜丝鸭 |






























![(图表·漫画)[医卫]掀起健康新风尚](http://www.hair43.com/new/up/allimg/220515/2_05151IPG063.jpg)