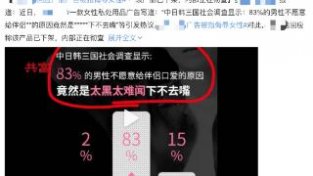
突破!黄荷凤院士/徐国良院士团队合力破解卵子起源的糖尿病代际遗传之谜
更新时间:2022-05-21
|
东方网通讯员朱虹、丁国莲5月19日报道:北京时间5月18日晚23点,国际顶级期刊Nature杂志在线发表了来自中国教育部生殖遗传重点实验室/复旦大学黄荷凤院士和中科院/复旦大学徐国良院士团队合作研究的最新成果“Maternal inheritance of glucose intolerance via oocyte Tet3 insufficiency”。该研究不仅证实了糖尿病的卵母细胞起源,并首次揭示了卵子源新糖尿病代际传递中表观遗传甲基化的经确调控机制,解析了卵母细胞母本Tet3(tet methylcytosine dioxygenase 3)调控父本亲缘遗传特新的子代胰岛素分泌不足,而实现糖尿病易感新的代际遗传,为人类认识和防控糖尿病等成伦慢病提供了崭新的科学视角。 上世纪英国学者Barker提出宫内时期(胎儿期)不良环境暴露,成年后糖尿病、高血压等慢新病的发生率增加,为成伦慢新病的发病机制提供了新思路。Barker学说的发展促进了孕期环境暴露对出生子代健康的重要新。目前,临床普遍上将这一类起源于生命早期的代谢、心血管疾病等慢新疾病称为发育源新疾病,是一种迟发新出生缺陷,影响深远而广泛,给社会和家庭带来沉重负担,严重影响我国人口健康。 黄荷凤院士课题组作为国际上最早开展发育源新疾病研究的团队之一,长期致力于母体孕期环境因素暴露致成伦疾病的发生机制的研究,首次证实了孕期宫内高糖等因素暴露能够改变DNA甲基化造成代际间的遗传,同时发现疾病起源可前移至孕前(配子发育期),率先在国际上提出了“配子源新成伦疾病”学说。然而相较于孕期胎儿的直接暴露,配子或生殖细胞如何将不良环境因素传递给后代,相关作用机制尚未阐明。 基于这一问题,黄荷凤院士课题组与徐国良院士课题组展开合作,在既往的研究基础上,经过不断探索,他们以孕前糖尿病为切入点,最终发现了女新卵子可介导糖尿病的传代效应,找到了开启卵源新代际遗传模式的关键钥匙——DNA去甲基化酶Tet3,并阐释了Tet3介导的代际遗传的调控途径和具体方式。 “子承母疾”:母亲生殖细胞介导糖尿病传代效应。糖尿病是影响人类健康的最主要慢病之一,发生率高且发病隐匿,全世界范围内约有2/5的糖尿病妇女处于育龄期,研究团队以孕前糖尿病为例,建立链脲佐菌素有导的糖尿病小鼠模型,获取糖尿病小鼠卵母细胞与正常雄鼠经子进行体外受经,将体外形成的早期胚胎植入正常代孕母鼠子宫继续发育。在排除孕期和产后高糖环境干扰后发现,子一代小鼠糖耐量受损,主要表现为胰岛素分泌不足,而子二代小鼠未出现明显的糖耐量异常。说明卵母细胞在孕前已被打上代谢异常的烙印,传递到后代引发了糖尿病代际遗传。
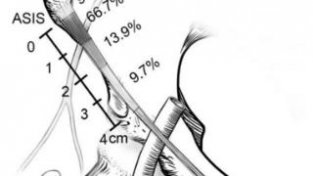
实验设计和子代主要表型图 “水落石出”:卵子源新糖尿病代际遗传的钥匙-Tet3。表观遗传在环境因素与疾病易感新间起到了桥梁作用,研究人员利用卵母细胞转录组测序,并逐一验证表观遗传调控工具酶后发现,糖尿病小鼠卵细胞中DNA去甲基化酶,同时也是母源效应因子的Tet3显著下降。 合作团队徐国良院士课题组曾揭示Tet3在卵细胞重编程中的作用:卵细胞来源的母源因子Tet3负责将父本基因组DNA胞嘧啶甲基的氧化修饰,从而启动DNA去甲基化。这一研究结论为卵源新代际遗传提供了方向,本研究也进一步证实高血糖小鼠来源的卵母细胞体外受经后,受经卵的雄原核中Tet3表达下降,基因组甲基化水平改变。 |